鐵元素是生產生活中的一種重要的金屬元素,其最常見的價態是+2、+3價,但在堿性條件的溶液中也可能會以+6價的形式存在,如高鐵酸根離子(化學式為FeO2-4,具有強氧化性,其鈉鹽或鉀鹽均可用作水處理劑)。某些鐵鹽溶于水中可生成Fe(OH)3膠體,可用作凈水劑。
(1)高鐵酸鈉(Na2FeO4)是一種水處理劑,因為它具有 強氧化強氧化性,可對水殺菌消毒;一定條件下,向NaClO與NaOH的混合溶液中加入FeCl3溶液,發生反應可得到高鐵酸鈉,該反應的化學方程式為 2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O;根據信息,分析Na2FeO4可除去水中的微細懸浮物的原因 高鐵酸鈉溶于水時,會與水反應生成Fe(OH)3膠體高鐵酸鈉溶于水時,會與水反應生成Fe(OH)3膠體。
(2)鐵元素的單質及其部分化合物的轉化關系如圖:

①溶液D→溶液E的過程中,試劑2作 氧化劑氧化劑(填“氧化劑”或“還原劑”,溶液B中含有的金屬陽離子為 Fe2+、Fe3+Fe2+、Fe3+(填離子符號)。
②高溫條件下,鐵與水蒸氣反應生成固體A的反應的化學方程式為 3Fe+4H2O(g)高溫
Fe3O4+4H23Fe+4H2O(g)高溫
Fe3O4+4H2。
③溶液E→溶液F的過程中溶液顏色變化的原因是 溶液E中的Fe3+與SCN-結合得到紅色的Fe(SCN)3溶液E中的Fe3+與SCN-結合得到紅色的Fe(SCN)3(用文字說明)。
④某同學向溶液D中直接滴入NaOH溶液,可觀察到的現象為 先有白色絮狀沉淀生成,然后白色絮狀沉淀迅速變成灰綠色,最終變成紅褐色先有白色絮狀沉淀生成,然后白色絮狀沉淀迅速變成灰綠色,最終變成紅褐色。
F
e
O
2
-
4
高溫 |
高溫 |
【答案】強氧化;2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O;高鐵酸鈉溶于水時,會與水反應生成Fe(OH)3膠體;氧化劑;Fe2+、Fe3+;3Fe+4H2O(g)
Fe3O4+4H2;溶液E中的Fe3+與SCN-結合得到紅色的Fe(SCN)3;先有白色絮狀沉淀生成,然后白色絮狀沉淀迅速變成灰綠色,最終變成紅褐色
高溫 |
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:33引用:1難度:0.5
相似題
-
1.下列有關化學反應的敘述正確的是( )
A.向氯化鐵溶液中滴加少量氨水,可制備氫氧化鐵膠體 B.常溫下可用鐵罐貯運濃硫酸,是因為鐵和濃硫酸不反應 C.SO2 與過量氨水反應生成(NH4)2SO3 D.室溫下Na與空氣中O2反應制取Na2O2 發布:2024/11/4 8:0:2組卷:59引用:1難度:0.5 -
2.下面是提純大理石(主要雜質是氧化鐵)的流程圖:
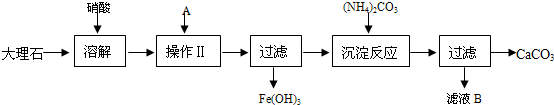
按要求回答下列問題:
(1)大理石與硝酸反應的離子方程式是.
(2)操作Ⅱ中A物質最好應選擇(①-KOH、②-CaO、③-CuO填序號),加入A生成Fe(OH)3沉淀的離子方程式是.
(3)濾液B的主要溶質的化學式是.
(4)由濾液B得到晶體B,操作過程包括(填操作名稱)、冷卻結晶.
(5)某化學小組在實驗中用濃硝酸和銅反應制取二氧化氮并探究二氧化氮是否能支持木炭的燃燒,其實驗裝置圖如下: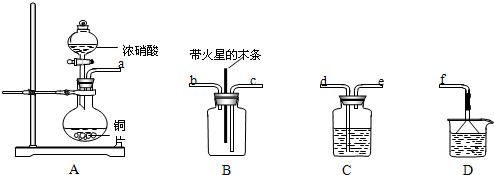
①按氣流方向連接各儀器接口,順序為a→→→→→f.裝置C、裝置D的作用分別是、.
②實驗開始后,能證明二氧化氮支持燃燒的實驗現象是.
③已知二氧化氮和碳反應生成兩種物質的量比為1:1有毒氣體,則該反應的化學方程式為:.發布:2024/11/13 8:0:1組卷:13引用:1難度:0.5 -
3.硫酸亞鐵是一種重要的化工原料,可以制備一系列物質(如圖所示)。下列說法錯誤的是( )
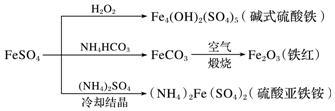
A.堿式硫酸鐵可用作凈水劑,該過程發生物理變化和化學變化 B.該溫度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 C.可用KSCN溶液檢驗(NH4)2Fe(SO4)2是否被氧化 D.為防止NH4HCO3分解,生產FeCO3需在較低溫度下進行 發布:2024/10/25 17:0:1組卷:109引用:1難度:0.6


