酸、堿、鹽是幾類重要化合物,它們與人類日常生活和工農業生產關系十分密切。
(1)日常生活中有以下常見物質:白醋、純堿、小蘇打、苛性鈉、硫酸銨,其中屬于堿的是 苛性鈉苛性鈉。
(2)小林同學在做實驗時,不慎將氫氧化鈉溶液弄到皮膚上,應立即 用大量水沖洗用大量水沖洗,再涂上硼酸溶液。
(3)為探究中和反應,興趣小組的同學設計了如圖所示的實驗。
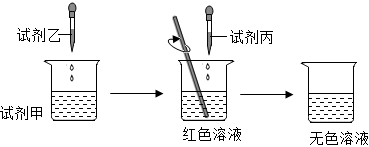
①圖中甲、乙、丙分別是稀鹽酸、氫氧化鈉溶液、無色酚酞溶液中的一種,則通過分析可知試劑丙是其中的 稀鹽酸稀鹽酸。
②小宸為理解鹽酸和氫氧化鈉兩者之間發生的反應的微觀實質,繪制了如圖。請你在圖中的圓圈中填入適當的化學用語。
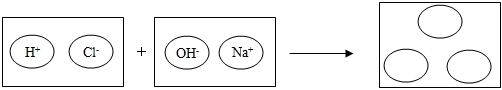
(4)為除去粗鹽中的泥沙和MgCl2、CaCl2、Na2SO4雜質,興趣小組按下列流程進行實驗探究。
粗鹽→溶解→依次加入過量的氯化鋇溶液、氫氧化鈉溶液、碳酸鈉溶液→過濾→蒸發、結晶→氯化鈉
①溶解、過濾、蒸發操作中都要用到的一種玻璃儀器是 玻璃棒玻璃棒。
②流程中加入氫氧化鈉溶液發生的反應的化學方程式為 2NaOH+MgCl2=Mg(OH)2↓+2NaCl2NaOH+MgCl2=Mg(OH)2↓+2NaCl。
③以上實驗流程還需進一步完善,請加以補充 過濾后加入適量的稀鹽酸(合理即可)過濾后加入適量的稀鹽酸(合理即可)。
(5)為了測定某生鐵樣品中鐵的質量分數,稱取5.8g該生鐵樣品放入燒杯中,向其中加入50g稀硫酸,恰好完全反應,稱量燒杯中物質的總質量為55.6g(生鐵樣品中雜質不溶于水,也不與稀硫酸反應)。則5.8g該生鐵樣品中鐵的質量是多少?
【答案】苛性鈉;用大量水沖洗;稀鹽酸;玻璃棒;2NaOH+MgCl2=Mg(OH)2↓+2NaCl;過濾后加入適量的稀鹽酸(合理即可)
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:22引用:3難度:0.4
相似題
-
1.在“粗鹽的初步提純”實驗中,下列操作正確的是( )
A. 
取用B. 
溶解C. 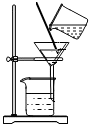
過濾D. 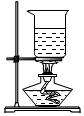
蒸發發布:2024/12/25 16:0:1組卷:136引用:3難度:0.7 -
2.多角度認識溶液,有助于我們更好地了解其在生產生活中的重要作用.
(1)物質在水中的分散
①食鹽是重要的調味品,其主要成分氯化鈉是由構成的(選填“分子”、“原子”或“離子”),將適量食鹽加入水中,充分攪拌后能形成溶液.
②食用油加入水中,充分攪拌能形成乳濁液.洗潔精洗滌油膩的碗筷是利用原理.
③面粉加入水中,充分攪拌后能形成懸濁液.除去懸濁液中難溶性的面粉可用的操作方法是.
(2)溶液的性質
①關于溶液的說法正確的有(填標號).
A.鹽酸是純凈物 B.溶液是均一、穩定的
C.溶液的酸堿度可用石蕊溶液測定 D.飽和溶液不一定是濃溶液
②有些固體物質溶解形成溶液后會呈現不同的顏色,如品紅溶液是紅色的,放入活性炭可使紅色褪去,這利用活性炭的作用.
③a,b兩種物質的溶解度曲線如圖1所示.下列說法正確的是
A.a物質的溶解度一定大于b物質的溶解度
B.將a溶液從t2℃時降溫到t1℃時,一定有晶體析出
C.t1℃時,a、b兩種物質飽和溶液的溶質質量分數相等
D.將t2℃時b的飽和溶液變為不飽和溶液,可采取降溫的方法
(3)溶液的變化
將一定質量的飽和氯化鈉溶液通電一段時間后,下列敘述正確的是
通電
(反應原理為:2NaCl+2H2O═2NaOH+H2↑+Cl2↑)
A.溶液的pH逐漸減小 B.溶液中鈉元素的質量增大
C.溶液中氧元素的質量分數不變 D.氯化鈉溶液的溶質質量分數減小
(4)如圖2是“粗鹽中難溶性雜質的去除”的實驗操作示意圖:
①儀器a的名稱.
②操作A中托盤兩邊各放一張大小相同的紙片,其作用是.
③操作B中還需要用到的儀器是.
④操作 C過濾時倒入液體的液面要低于濾紙邊緣主要是為了防止(填字母).
A.過濾速度慢 B.濾紙破損 C.雜質未經過濾就進入濾液
⑤圖中部分操作有錯誤,其中有的錯誤會導致精鹽產率明顯偏低,其原因是.發布:2025/1/1 8:0:2組卷:55引用:1難度:0.5 -
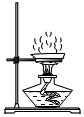 3.去除難溶性雜質后的食鹽樣品中還含有可溶性雜質:CaCl2、MgCl2和Na2SO4.為除去可溶性雜質,將食鹽樣品溶于水,依次加入稍過量的三種溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反應后過濾,得濾渣X,向濾液中加入過量的稀鹽酸,攪拌、煮沸,得氯化鈉溶液。下列說法正確的是( )
3.去除難溶性雜質后的食鹽樣品中還含有可溶性雜質:CaCl2、MgCl2和Na2SO4.為除去可溶性雜質,將食鹽樣品溶于水,依次加入稍過量的三種溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反應后過濾,得濾渣X,向濾液中加入過量的稀鹽酸,攪拌、煮沸,得氯化鈉溶液。下列說法正確的是( )A.濾渣X中有三種成分 B.“向濾液中加入過量的稀鹽酸”目的只是為了除去過量的NaOH C.除雜過程中有Na2CO3參加的化學反應為復分解反應 D.將氯化鈉溶液用題圖裝置加熱蒸發,至水分完全蒸干時停止加熱 發布:2024/12/25 15:30:1組卷:740引用:8難度:0.5


