當前位置:
試題詳情
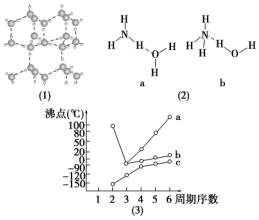 (1)水分子間存在一種“氫鍵”(介于范德華力與化學鍵之間)的作用,彼此結(jié)合而形成(H2O)n.在冰中每個水分子被4個水分子包圍形成變形的正四面體,通過氫鍵相互連接成龐大的分子晶體,其結(jié)構(gòu)示意圖如圖(1)表示:
(1)水分子間存在一種“氫鍵”(介于范德華力與化學鍵之間)的作用,彼此結(jié)合而形成(H2O)n.在冰中每個水分子被4個水分子包圍形成變形的正四面體,通過氫鍵相互連接成龐大的分子晶體,其結(jié)構(gòu)示意圖如圖(1)表示:
①1mol冰中有22mol 氫鍵.
②在冰的結(jié)構(gòu)中,每個水分子與相鄰的4個水分子以氫鍵相連接.在冰晶體中除氫鍵外,還存在范德華力(11kJ?mol-1).已知冰的升華熱是51kJ?mol-1,則冰晶體中氫鍵的能量是2020kJ?mol-1.
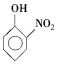
③氨氣極易溶于水的原因之一也與氫鍵有關(guān).請判斷NH3溶于水后,形成的NH3?H2O的合理結(jié)構(gòu)是bb[填圖 (2)中的序號].
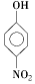
(2)圖(3)折線c可以表達出第ⅣAⅣA族元素氫化物的沸點的變化規(guī)律.兩位同學對某主族元素氫化物的沸點的變化趨勢畫出了兩條折線a和b,你認為正確的是:bb(填“a”或“b”);部分有機物的熔沸點見下表:
| 烴 | CH4 | CH3CH3 | CH3 (CH2)2CH3 |
硝基苯酚 |
|

|
|
| 沸點/℃ | -164 | -88.6 | -0.5 | 熔點/℃ | 45 | 96 | 114 |
有機物相對分子質(zhì)量越大,分子間作用力越強,故沸點越高
有機物相對分子質(zhì)量越大,分子間作用力越強,故沸點越高
,當有機物能形成分子內(nèi)氫鍵時,分子間作用力減弱,熔點變低;當分子間能形成氫鍵時,分子間作用力增強,熔點升高
當有機物能形成分子內(nèi)氫鍵時,分子間作用力減弱,熔點變低;當分子間能形成氫鍵時,分子間作用力增強,熔點升高
(至少寫2條).【考點】含有氫鍵的物質(zhì).
【答案】2;20;b;ⅣA;b;有機物相對分子質(zhì)量越大,分子間作用力越強,故沸點越高;當有機物能形成分子內(nèi)氫鍵時,分子間作用力減弱,熔點變低;當分子間能形成氫鍵時,分子間作用力增強,熔點升高
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/12/30 15:0:1組卷:148引用:2難度:0.1
相似題
-
1.下列說法正確的是( )
A.純堿和燒堿熔化時克服的化學鍵類型相同 B.HF在高溫下也不容易分解,是因為HF分子之間存在氫鍵 C.SiO2和CO2熔點相差很大,是因為Si-O的鍵能比C=O的鍵能大 D.在HCl分子中,各原子最外電子層都形成了具有8個電子的穩(wěn)定結(jié)構(gòu) 發(fā)布:2024/12/30 11:30:1組卷:60引用:2難度:0.7 -
2.下列各項敘述中,正確的是( )
A.醫(yī)學上研究發(fā)現(xiàn) 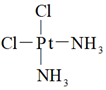 具有抗癌作用,而
具有抗癌作用,而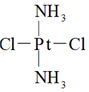 沒有抗癌作用,說明兩種分子互為同分異構(gòu)體,都是以Pt原子為中心的平面結(jié)構(gòu)
沒有抗癌作用,說明兩種分子互為同分異構(gòu)體,都是以Pt原子為中心的平面結(jié)構(gòu)B.價電子排布為ns1的元素,不一定是s區(qū)元素 C.水中的氫鍵可以表示為O-H...O,冰中每摩爾H2O有4NA個氫鍵 D.與基態(tài)鉀原子同周期且未成對電子數(shù)相同的元素還有4種 發(fā)布:2025/1/6 6:0:5組卷:19引用:1難度:0.7 -
3.下列現(xiàn)象不能用氫鍵解釋的是( )
A.冰的密度小于液態(tài)水 B.氨易液化 C.HF 的沸點高于HI D.HCl 比 HI 分子更穩(wěn)定 發(fā)布:2024/12/30 15:30:1組卷:71引用:3難度:0.8


