中國是四大文明古國之一,各民族的祖先共同創造了燦爛的古代科學文化,在化學領域中也有廣泛的開拓,產生很多意義重大的創造發明。
(1)晉代葛洪著有《抱樸子》,其中談到“丹砂燒之成水銀,積變又還成丹砂”,在化學萌芽時期,就對化學反應的可逆性有了研究。其中涉及到了反應HgS+O2 點燃 Hg+SO2。該反應中,氧元素化合價的變化情況是 降低降低(選填“升高”、“降低”或“不變”之一)。

(2)西漢劉安所著的《淮南萬畢術》中記載著“曾青得鐵則化為銅”。到了宋代和元代,我國濕法煉銅的工藝已經相當成熟,成為當時大規模生產金屬銅的主要方法之一。把鐵放入硫酸銅溶液中會得到銅,該反應的化學方程式為 Fe+CuSO4=Cu+FeSO4Fe+CuSO4=Cu+FeSO4。

(3)現代化學產品制備正向著綠色、低碳、可持續的方向發展。
①工業制備硫酸銅的兩種方案原理如下:
Ⅰ:Cu+2H2SO4(濃)=CuSO4+SO2↑+2H2O
Ⅱ:2Cu+O2 △ 2CuO CuO+H2SO4=CuSO4+H2O
某化學小組同學探究制備硫酸銅的新方案,原理如下:
Ⅲ:Cu+H2O2+H2SO4=CuSO4+2H2O
綜合評價制備CuSO4的方案,下列說法中,不正確的是 BB(選填字母序號之一)。
A.方案Ⅲ比方案Ⅰ更環保
B.消耗等質量銅,方案Ⅲ生成CuSO4最多
C.方案Ⅲ比方案Ⅱ更節能
②現取115.3gCuSO4溶液倒入燒杯中,慢慢向燒杯中加入溶質質量分數為10%的BaCl2溶液,反應過程中產生沉淀的質量與所加入BaCl2溶液的質量關系如圖所示。試回答:
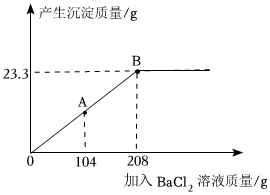
Ⅰ.當加入BaCl2溶液104g時(圖中A點),燒杯中溶液里大量存在的酸根離子是 Cl-、SO2-4Cl-、SO2-4。(填離子符號)
Ⅱ.當加入BaCl2溶液208g時(圖中B點),恰好完全反應,試通過計算,求此時燒杯中所得不飽和溶液中溶質的質量分數。(結果精確至0.1%)
點燃
△
SO
2
-
4
SO
2
-
4
【答案】降低;Fe+CuSO4=Cu+FeSO4;B;Cl-、
SO
2
-
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:41引用:1難度:0.4
相似題
-
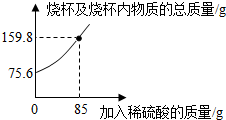 1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
(1)該實驗取用的樣品質量為g.
(2)計算樣品中鐵的質量分數(寫出解題過程).發布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
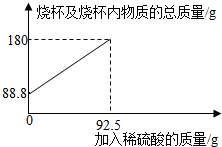 2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
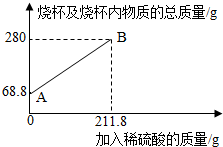 3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)求樣品中鐵的質量分數;反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


