化工專家侯德榜發明的侯氏制堿法為我國純堿工業和國民經濟發展做出了重要貢獻。
某化學興趣小組在實驗室中模擬并改進侯氏制堿法制備NaHCO3,進一步處理得到產品Na2CO3和NH4Cl,實驗流程如圖:

回答下列問題:
(1)從A~E中選擇合適的儀器制備NaHCO3,正確的連接順序是 aefbcghaefbcgh(按氣流方向,用小寫字母表示)。

(2)B中使用霧化裝置的優點是 使氨鹽水霧化,可增大與二氧化碳的接觸面積,從而提高產率使氨鹽水霧化,可增大與二氧化碳的接觸面積,從而提高產率。
(3)生成NaHCO3的總反應的化學方程式為 NH3?H2O+NaCl+CO2=NH4Cl+NaHCO3↓NH3?H2O+NaCl+CO2=NH4Cl+NaHCO3↓。
(4)反應完成后,將B中U形管內的混合物處理得到固體NaHCO3和濾液:
①對固體NaHCO3充分加熱,產生的氣體先通過足量濃硫酸,再通過足量Na2O2,Na2O2增重0.14g,則固體NaHCO3的質量為 0.84g0.84gg。
②向濾液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)═NaCl(aq)+NH4Cl(s)過程.為使NH4Cl沉淀充分析出并分離,根據NaCl和NH4Cl溶解度曲線,需采用的操作為 蒸發濃縮蒸發濃縮、冷卻結晶冷卻結晶、過濾、洗滌、干燥。

【考點】純堿工業(侯氏制堿法).
【答案】aefbcgh;使氨鹽水霧化,可增大與二氧化碳的接觸面積,從而提高產率;NH3?H2O+NaCl+CO2=NH4Cl+NaHCO3↓;0.84g;蒸發濃縮;冷卻結晶
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:190引用:3難度:0.6
相似題
-
1.“侯氏制堿法”的主要過程如圖(部分物質已略去)。
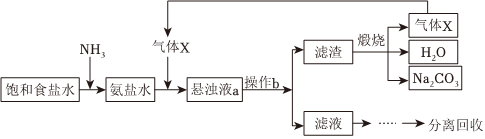
下列說法錯誤的是( )A.氣體X為CO2 B.操作b為過濾 C.懸濁液a中的不溶物主要是NH4Cl D.氨鹽水中通入氣體X后,溶液中Na+大量減少 發布:2024/12/8 0:0:1組卷:132引用:4難度:0.7 -
2.以NaCl為原料,可制取純堿。Na2CO3可用侯氏制堿法制取,主要涉及如下反應:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,下列有關實驗室模擬侯氏制堿法的實驗原理和裝置正確的是( )△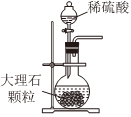
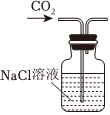
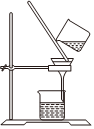
A.制取CO2 B.制取NaHCO3 C.分離NaHCO3 D.制取Na2CO3 A.A B.B C.C D.D 發布:2024/12/8 18:0:1組卷:164引用:5難度:0.8 -
3.氨堿法(索氏)和聯合制堿法(侯氏)是兩大重要的工業制堿法,下列表達正確的是( )
氨堿法 聯合制堿法 A 原料 食鹽、氨氣、生石灰 食鹽、氨氣、二氧化碳 B 副產物 氯化鈣 氯化銨 C 循環物質 氨氣、二氧化碳 氯化鈉 D 評價 原料易得、設備簡單、能耗低 原料利用率高、廢棄物少 A.A B.B C.C D.D 發布:2024/12/16 6:0:1組卷:38引用:2難度:0.8


