在水的電離平衡中,c(H+)和c(OH-)的關系如圖所示:
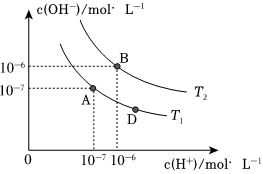
(1)A點水的離子積為1.0×10-14,B點水的離子積為 1.0×10-121.0×10-12。造成水的離子積變化的原因是 水的電離是吸熱過程,溫度升高,促進水的電離,Kw增大水的電離是吸熱過程,溫度升高,促進水的電離,Kw增大。
(2)下列說法正確的是 aa(填字母)。
a.圖中A、B、D三點處Kw的大小關系:B>A=D
b.AB線上任意點的溶液均顯中性,且Kw不變
c.B點溶液的pH=6,顯酸性
d.圖中溫度T1>T2
(3)T1時,若向溶液中滴加NaOH,能否使體系處于A點位置?否否,為什么?A點為中性,加入NaOH,c(OH-)>c(H+),不可能處于A點A點為中性,加入NaOH,c(OH-)>c(H+),不可能處于A點。
(4)T1時,CH3COONa溶液中離子濃度由大到小為 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
【考點】水的電離.
【答案】1.0×10-12;水的電離是吸熱過程,溫度升高,促進水的電離,Kw增大;a;否;A點為中性,加入NaOH,c(OH-)>c(H+),不可能處于A點;c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:22引用:2難度:0.7
相似題
-
1.下列物質溶解于水時,電離出的陽離子能使水的電離平衡向右移動的是( )
A.NH4Cl B.CH3COONa C.H2SO4 D.KNO3 發布:2024/12/5 20:30:2組卷:42引用:2難度:0.8 -
2.25℃時水的電離達到平衡:H2O?H++OH-ΔH>0,下列敘述不正確的是( )
A.將水加熱,Kw增大,pH減小 B.向水中加入少量硫酸氫鈉固體, 增大c(H+)c(OH-)C.在蒸餾水中滴加濃H2SO4,Kw不變,c(H+)增大 D.向水中滴入少量NaOH溶液,平衡逆向移動,c(H+)降低 發布:2024/12/10 10:30:1組卷:246引用:5難度:0.7 -
3.下列關于水的電離H2O?H++OH-ΔH>0的說法不正確的是( )
A.將水加熱至50℃,水的電離平衡正向移動,水依然呈中性 B.向水中加入少量NaOH,水的電離平衡逆向移動,溶液呈堿性 C.向水中加入少量NH4Cl,水的電離平衡正向移動,溶液呈酸性 D.常溫下,pH=2的鹽酸中,水電離的c(H+)=1.0×10-2mol?L-1 發布:2024/12/30 3:30:1組卷:93引用:6難度:0.8


