氫氧化鈉是一種重要的化工原料,也是初中化學實驗中常用的試劑。
Ⅰ.興趣小組小葉同學要用氫氧化鈉固體配制一定質量的某濃度的氫氧化鈉溶液,該實驗的主要步驟:計算、稱量、量取稱量、量取、溶解,其中配制過程中,用于溶解氫氧化鈉固體的燒杯內壁帶有水滴,會導致溶液濃度 偏小偏小(填“偏大”“偏小”或“不變”)。
Ⅱ.小葉同學想利用電導率傳感器深入了解,在常溫下氫氧化鈉固體溶于水的過程中溶液導電性的變化,直接將一定質量的氫氧化鈉固體加入盛有100mL蒸餾水的燒杯中,測得不同時間下的電導率數據如圖-1所示:
已知:電導率傳感器用于測量溶液的導電性強弱。一定條件下,溶液中離子濃度越大,溫度越高,溶液電導率越大。
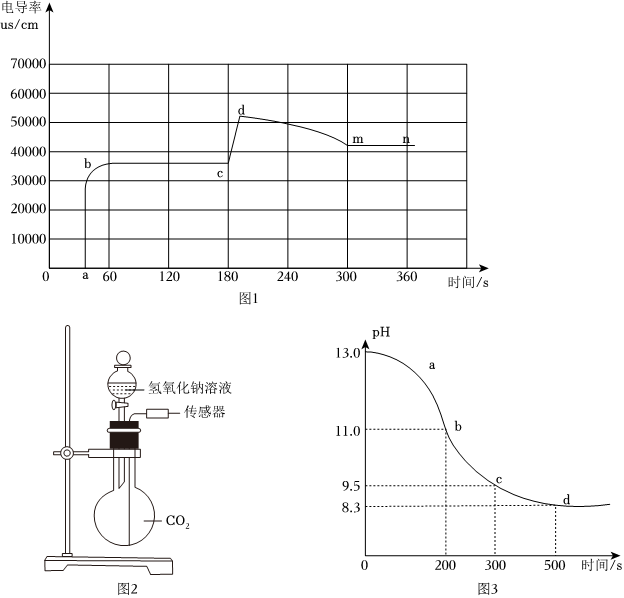
①由圖-1可知:a點到b點過程中,用玻璃棒攪拌的目的是 攪拌,加速溶解攪拌,加速溶解。
②在60s到180s時間內,c點的電導率不再變化,小葉繼續向其中加入一定量的氫氧化鈉固體,并用玻璃棒攪拌,固體迅速溶解,同時電導率很快升高到d點,一段時間后,c點溶液 不是不是 (填“是“或“不是”)飽和溶液,d點到m點電導率降低的原因是 溫度降低,溶液電導率減小溫度降低,溶液電導率減小。
③小葉同學想在n點后讓電導率再次有明顯升高,請你選擇少量 bb(填序號)。
a.碳酸鈣固體
b.硫酸鈉固體
c.氫氧化銅固體
Ⅲ.興趣小組中小夏同學為了探究氫氧化鈉溶液與二氧化碳反應的產物,設計了圖-2的裝置,在20℃時,向充滿二氧化碳氣體的2L燒瓶中一次性加入200g2%的氫氧化鈉溶液,并用數字化實驗技術測得反應過程中溶液的pH隨時間的變化如圖-3所示,完成下列問題:
資料:1.在20℃時,二氧化碳的密度是1.977g/L。
2.本實驗條件下,Na2CO3溶液的pH約為11.0,NaHCO3 溶液的pH約為8.3。
3.通入過量的CO2時,反應化學方程式是Na2CO3+CO2+H2O=2NaHCO3。
4.本實驗條件下,含有HCO-3的鹽濃度小,與鈣鹽不反應;BaCO3難溶于水。
①實驗前200s,圓底燒瓶內壓強會減小,產生這一現象的原因是 CO2+2NaOH=Na2CO3+H2OCO2+2NaOH=Na2CO3+H2O(用化學方程式表示)。
②根據圖-3,200g2%的氫氧化鈉溶液與一定量二氧化碳剛好完全反應全部生成碳酸鈉和水,則生成碳酸鈉的質量是多少?(要求計算過程)
③小夏同學結合圖-3對充分反應后的溶質組成產生了濃厚的興趣。設計如下實驗。
HC
O
-
3
| 實驗步驟 | 實驗現象 | 實驗結論 |
| (1)用玻璃棒蘸取反應后的溶液,滴在pH試紙上 | pH約為9 | 溶液呈堿性 |
| (2) 取反應后溶液少許與試管中,向其中滴加過量的氯化鋇溶液 取反應后溶液少許與試管中,向其中滴加過量的氯化鋇溶液 |
產生白色沉淀 產生白色沉淀
|
溶液含有碳酸鈉 |
| (3)取少量步驟(2)中的上層清液于試管中,滴加稀鹽酸 | 有氣體產生 | 溶液含有碳酸氫鈉 |
④小希同學認為不需要設計以上實驗就能證明反應結束后溶液含有碳酸鈉和碳酸氫鈉,請說明原因?
氫氧化鈉的質量為200g×2%=4g,二氧化碳與4g氫氧化鈉剛好完全反應全部生成碳酸鈉和水,需二氧化碳的質量為2.2g,二氧化碳與4g氫氧化鈉剛好完全反應全部生成碳酸氫鈉,需二氧化碳的質量為4.4g,而二氧化碳的質量為2L×1.977g/L=3.954g,故反應結束后溶液含有碳酸鈉和碳酸氫鈉
氫氧化鈉的質量為200g×2%=4g,二氧化碳與4g氫氧化鈉剛好完全反應全部生成碳酸鈉和水,需二氧化碳的質量為2.2g,二氧化碳與4g氫氧化鈉剛好完全反應全部生成碳酸氫鈉,需二氧化碳的質量為4.4g,而二氧化碳的質量為2L×1.977g/L=3.954g,故反應結束后溶液含有碳酸鈉和碳酸氫鈉
。(利用提供的數據)【答案】稱量、量取;偏小;攪拌,加速溶解;不是;溫度降低,溶液電導率減小;b;CO2+2NaOH=Na2CO3+H2O;取反應后溶液少許與試管中,向其中滴加過量的氯化鋇溶液;產生白色沉淀;氫氧化鈉的質量為200g×2%=4g,二氧化碳與4g氫氧化鈉剛好完全反應全部生成碳酸鈉和水,需二氧化碳的質量為2.2g,二氧化碳與4g氫氧化鈉剛好完全反應全部生成碳酸氫鈉,需二氧化碳的質量為4.4g,而二氧化碳的質量為2L×1.977g/L=3.954g,故反應結束后溶液含有碳酸鈉和碳酸氫鈉
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/5/16 8:0:9組卷:47引用:1難度:0.4
相似題
-
 1.家庭廚房就是一個充盈的化學小世界,“柴米油鹽醬醋糖”中包含著許多化學內容.
1.家庭廚房就是一個充盈的化學小世界,“柴米油鹽醬醋糖”中包含著許多化學內容.
(1)米、面的主要成分都是由三種元素組成的淀粉,淀粉屬于糖類.
(2)水瓶內的水垢主要成分是碳酸鈣,可用(填一種調味品)除去.
(3)白糖與紅糖主要成分都是蔗糖.利用活性炭的性,可將紅糖脫色成白糖.
(4)市場上銷售的香腸、鹽水鴨、榨菜、豆腐干等食品,常采用真空包裝,其目的是防止食品而變質.
(5)味精是烹制菜肴時常用的調味品,小明研究某品牌味精包裝上的部分文字說明后,想測定此味精中氯化鈉的含量.
[查閱資料]NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸鈉的存在不影響NaCl性質.
[實驗過程]
①稱取該味精樣品10.0g,并溶于蒸餾水
②加入過量的硝酸銀溶液,過濾
③用蒸餾水反復洗滌沉淀多次
④將沉淀烘干、稱量,測得固體質量為5.74g
根據上述實驗步驟回答下列有關問題:
①過濾操作所需要的儀器除燒杯、鐵架臺(帶鐵圈)、玻璃棒外,還需要的玻璃儀器是.
②試通過計算確定此樣品中NaCl質量分數與其包裝上標注的含量是否相符.發布:2025/1/6 8:0:1組卷:68引用:2難度:0.5 -
2.化學興趣小組同學們在老師的指導下對市售某品牌“鈣片”的補鈣原理、成分以及功效展開了項目化學習的探究。
【查閱資料】
(1)該補鈣劑的主要成分有碳酸鈣、維生素D3、硫酸鋅、水果香料等。
(2)維生素D3、水果香料都不溶于水也不與酸反應,維生素D3主要作用是促進人體對鈣的吸收。
項目一:探究“鈣片”補鈣原理。
【分析交流】
“鈣片”中鈣以碳酸鈣形式存在,“鈣片”進入胃首先要通過人體胃酸對其進行溶解后方可被吸收。
【進行實驗】
【反思評價】服用“鈣片”時,采用實驗方案 實驗現象 實驗結論或化學方程式 取適量“鈣片”粉末于試管中,滴加足量 。化學方程式 (填“吞服”或“嚼服”)的服藥方式更有利促進胃腸吸收。
項目二:探究“鈣片”中是否含有硫酸鋅。
項目三:探究“鈣片”的功效。實驗方案 實驗現象 實驗結論 另取少量“鈣片”粉末于試管中,加足量水,充分溶解,取適量上層清液于試管中,加入幾滴 。“鈣片”中含有硫酸鋅。
【交流討論】
該補鈣劑適用于中老年人治療因缺鈣導致的患者。老師建議大家應注意平時的飲食補鈣,牛奶、魚類等食物除富含營養素外,是較好的補鈣食物,應該多食用。發布:2025/1/3 16:0:5組卷:30引用:1難度:0.5 -
 3.酸、堿、鹽種類繁多,與人類生活和生產關系密切。請回答下列問題:
3.酸、堿、鹽種類繁多,與人類生活和生產關系密切。請回答下列問題:
(1)造紙業會產生大量含NaOH的堿性廢水,需經處理至中性排放。
①寫出NaOH的俗稱:(一個即可)。
②若某造紙廠廢水中NaOH的質量分數為1.6%,現有廢硫酸9.8t(H2SO4的質量分數為10%)。可以處理的廢水質量為t。
(2)某化學興趣小組做了如圖所示的兩個實驗。完成A、B兩個實驗后,同學們將實驗后的廢液傾倒入一個廢液缸中,發現廢液呈紅色,小組同學對廢液成分展開了如下探究。(該題實驗過程中所用溶液濃度較低;氯化鈣溶液和氯化鋇溶液顯中性;實驗中如涉及硫酸鈣、氫氧化鈣等微溶物,均可看做可溶物)
【交流討論】小組同學經討論分析后一致認為廢液中一定含有的溶質有氯化鈉和(酚酞除外)。
【提出猜想】廢液中還含有的物質:
猜想一:NaOH;
猜想二:Na2CO3;
猜想三:(填化學式)。
【實驗驗證】
甲同學取少量廢液于試管中,向其中加入過量的氯化鈣溶液,通過觀察現象,得出了正確結論。若猜想二正確,甲同學觀察到的現象:有白色沉淀生成,;請寫出發生反應的化學方程式:。
【交流與反思】乙同學認為,將甲同學實驗中的氯化鈣溶液換成氯化鋇溶液,也能得出正確結論。你認為乙同學的觀點是否正確并說明你的理由:。發布:2025/1/3 8:0:1組卷:94引用:1難度:0.5


