銅及其化合物的冶煉與人類生活、社會發展有密切聯系。
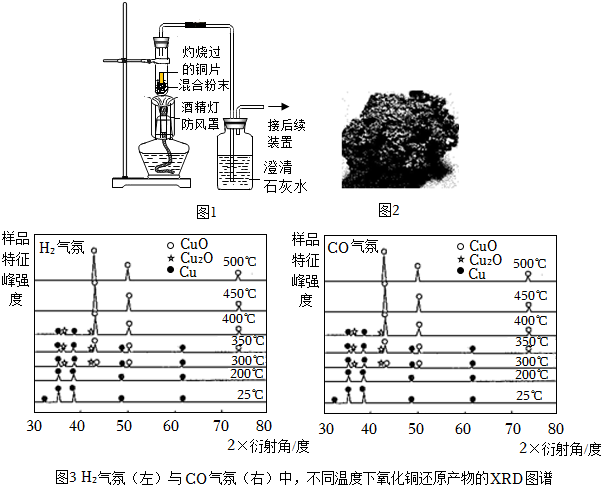
(1)在實驗室選擇如圖-1裝置探究木炭和氧化銅反應的最佳質量比。
【查閱資料】
①木炭能在較高溫度環境中將氧化銅中的氧元素奪去,生成單質銅
②酒精燈防風罩能將酒精燈火焰溫度提升至600~800℃
③銅的熔點為1083℃
【裝置分析】
①該實驗并未采用略向下傾斜試管的加熱方法,原因可能是 AA。
A.使火焰更好包裹住藥品部位,提高反應溫度
B.防止生成的氣體沖散藥品,降低實驗成功率
C.過程中會生成液態的銅,且防止石灰水倒吸
【實驗過程】
實驗:取0.1g木炭粉與一定量的氧化銅粉末按下表所示比例充分混合,在粉末堆中插入一塊灼燒過的銅片,進行實驗。
| 序號 | 木炭粉與氧化銅粉末混合質量比 | 充分反應后試管底部固體的顏色 | |
| (1) | 1:9 | 紅色固體有金屬光澤 | 混有少量黑色物質 |
| (2) | 1:10 | 混有很少量黑色物質 | |
| (3) | 1:11 | 混有極少量黑色物質 | |
| (4) | 1:12 | 無黑色物質 | |
| (5) | 1:13 | 混有少量黑色物資 | |
1:12
1:12
。③無需再進行木炭粉與氧化銅粉末質量比為1:14的實驗,原因是
木炭粉與氧化銅的質量比為1:13時,紅色粉末中已經混有少量黑色物質,說明氧化銅已經過量,無需做木炭粉與氧化銅質量比為1:14的實驗
木炭粉與氧化銅的質量比為1:13時,紅色粉末中已經混有少量黑色物質,說明氧化銅已經過量,無需做木炭粉與氧化銅質量比為1:14的實驗
。④取出銅片觀察,發現埋入粉末的部分變紅,有金屬光澤,上方銅片也變為亮紅色,右側澄清石灰水變渾濁,由此推測反應中產生的氣體一定有
二氧化碳或CO2
二氧化碳或CO2
。⑤某同學取8.0gCuO固體粉末與一定量木炭以最佳質量比混合,若CuO完全轉化為Cu,理論上預計能得到Cu的質量為
6.4g
6.4g
。⑥試管底部的亮紅色固體呈“海綿狀”,如圖-2所示,實驗得到“海綿銅”而非塊狀銅的原因是
碳與氧化銅充分混合,碳被消耗而酒精燈防風罩能將酒精燈火焰溫度為600~800℃,沒有達到銅的熔點銅的熔點為1083℃
碳與氧化銅充分混合,碳被消耗而酒精燈防風罩能將酒精燈火焰溫度為600~800℃,沒有達到銅的熔點銅的熔點為1083℃
。(2)分別在H2與CO氣氛下,還原氧化銅樣品。對反應后的樣品進行X射線衍射,得到的XRD圖譜結果如圖-3所示。XRD圖譜中的峰值可以表征某物種的存在。結合圖像說明,能否采用熱還原的方法直接制得純凈的Cu2O產品,
都不能
都不能
(填“用H2能”或“CO能”或“都能”或“都不能”),為什么 在有氧化亞銅產生的溫度時同時存在氧化銅、銅為混合物,得到不是純凈的氧化亞銅
在有氧化亞銅產生的溫度時同時存在氧化銅、銅為混合物,得到不是純凈的氧化亞銅
。【答案】A;1:12;木炭粉與氧化銅的質量比為1:13時,紅色粉末中已經混有少量黑色物質,說明氧化銅已經過量,無需做木炭粉與氧化銅質量比為1:14的實驗;二氧化碳或CO2;6.4g;碳與氧化銅充分混合,碳被消耗而酒精燈防風罩能將酒精燈火焰溫度為600~800℃,沒有達到銅的熔點銅的熔點為1083℃;都不能;在有氧化亞銅產生的溫度時同時存在氧化銅、銅為混合物,得到不是純凈的氧化亞銅
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:107引用:3難度:0.5
相似題
-
1.同學們在學習碳的化學性質之后得知碳燃燒時可能生成二氧化碳,也可能生成一氧化碳。某化學興趣小組對木炭還原氧化銅可能生成的氣體成分進行實驗探究。
【提出問題】碳與氧化銅反應可能生成什么氣體?
【提出猜想】猜想①:只生成CO2;
猜想②:;
猜想③:既生成CO,又生成CO2。
【查閱資料】浸有磷鉬酸溶液的氯化鈀試紙遇CO2無變化,但遇微量的CO會立即變成藍色。
【實驗驗證】小組同學經過思考之后,設計了如圖所示的實驗裝置:
步驟一:打開彈簧夾,先通一會兒純凈干燥的氮氣;
步驟二:關閉彈簧夾,點燃酒精噴燈對玻璃管加熱;
步驟三:實驗結束后,拆洗裝置和儀器。
(1)實驗開始時,先將氮氣通入實驗裝置一段時間再加熱的目的是。
(2)對A裝置的玻璃管集中加熱一段時間,玻璃管中黑色粉末逐漸變成紅色,B瓶中試紙變藍,C中澄清石灰水變渾濁。寫出C中發生反應的化學方程式:。
【實驗結論】(3)通過對實驗現象的分析,上述猜想(填序號)是正確的。
【實驗反思】(4)請從環保的角度分析,實驗裝置中存在的不完善之處是。發布:2024/7/24 8:0:9組卷:53引用:2難度:0.4 -
2.碳還原氧化銅的實驗裝置如圖甲、乙所示。
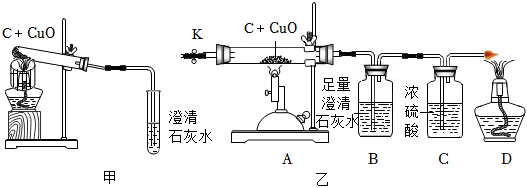
甲圖中酒精燈上網罩的作用是,鐵架臺夾持試管中發生反應的化學方程式為;反應結束后應先將導氣管從石灰水中移出,目的是。
【提出問題】碳燃燒時可能生成CO2也可能生成CO,那么碳與氧化銅反應生成的氣體是否也有多種可能?
【作出猜想】猜想Ⅰ:;
猜想Ⅱ:CO2;
猜想Ⅲ:CO和CO2的混合氣體。
【設計方案】實驗裝置如圖乙所示。打開K,緩緩通入干燥的氮氣一段時間,關閉K,點燃酒精噴燈和酒精燈,充分反應后,熄滅酒精噴燈和酒精燈,打開K,再通入一段時間氮氣。(提示:濃硫酸是除去氣體中的水分,使氣體干燥。)
(1)實驗時裝置A處玻璃管內的現象是;
(2)若B中石灰水變渾濁,該反應的化學方程式為,D處的氣體能點燃,則猜想(填序號)成立。
【交流反思】實驗開始前緩緩通入氮氣的目的是。發布:2024/7/11 8:0:9組卷:15引用:2難度:0.5 -
3.下列對九年級常見化學演示實驗的現象描述正確的是( )
A.紅磷在空氣中燃燒產生大量白霧 B.硫在空氣中燃燒,發出明亮的藍紫色火焰 C.高溫加熱碳與氧化銅的混合物,固體由黑色變成紅色 D.鐵絲在氧氣在劇烈燃燒,火星四射,生成黑色的四氧化三鐵 發布:2024/7/11 8:0:9組卷:8引用:2難度:0.5
相關試卷


