為了增強大氣污染防治的科學性、針對性和有效性,研究大氣顆粒物的化學組成和分布特征具有很重要的意義。水溶性離子是PM2.5的重要組成部分,主要包含SO2-4、NO-3、NH+4、Cl-、Na+、Ca2+、Mg2+等,這些離子多由化石燃料燃燒、機動車尾氣等排放的SO2、NOx、NH3等氣體經過復雜的大氣物理化學過程二次轉化而來。
(1)常溫下,將某地大氣污染物樣品配制成溶液,測得溶液的pH>7,該溶液顯 BB。
A.酸性
B.堿性
C.中性
(2)PM2.5中的SO2-4主要源自燃煤產生的SO2,寫出SO2轉化為H2SO4的化學方程式 SO2+H2O=H2SO3SO2+H2O=H2SO3、2H2SO3+O2=2H2SO42H2SO3+O2=2H2SO4。
硫氧化率(SOR)和氮氧化率(NOR)通常用來分別表示氣體污染物SO2和NO2向SO2-4和NO-3的轉化程度。SOR和NOR的計算公式為:SOR=n(SO2-4)n(SO2-4)+n(SO2),NOR=n(NO-3)n(NO-3)+n(NO2)。已知:PM2.5中SO2-4主要以(NH4)2SO4形式存在,NO-3主要以NH4NO3形式存在。(NH4)2SO4比NH4NO3更穩定;NH4NO3和HNO3加熱或光照均易分解。
某地SOR和NOR的數據如下表所示:
SO
2
-
4
NO
-
3
NH
+
4
SO
2
-
4
SO
2
-
4
NO
-
3
n
(
S
O
2
-
4
)
n
(
S
O
2
-
4
)
+
n
(
S
O
2
)
n
(
N
O
-
3
)
n
(
N
O
-
3
)
+
n
(
N
O
2
)
SO
2
-
4
NO
-
3
| 季節 | 春季 | 夏季 | 秋季 | 冬季 | 平均 |
| SOR | 0.29 | 0.42 | 0.28 | 0.26 | 0.31 |
| NOR | 0.21 | 0.14 | 0.23 | 0.25 | 0.21 |
B
B
。A.春季
B.夏季
C.秋季
D.冬季
結合相關化學原理推測該季節產生這種差異可能的原因
夏季溫度升高,氣體的體積增大,有利于反應向體積減小的方向移動,SO2更有利于轉化為(NH4)2SO4,而NH4NO3和HNO3加熱或光照均易分解,夏天溫度較高,光照充足,更有利于NH4NO3和HNO3分解,NO2含量增大
夏季溫度升高,氣體的體積增大,有利于反應向體積減小的方向移動,SO2更有利于轉化為(NH4)2SO4,而NH4NO3和HNO3加熱或光照均易分解,夏天溫度較高,光照充足,更有利于NH4NO3和HNO3分解,NO2含量增大
。(4)設r=
c
(
N
O
-
3
)
c
(
S
O
2
-
4
)
b
b
。
a.移動源污染
b.固定源污染
假如你是城市管理者,請你提出一條有針對性的措施,以緩解秋冬季節PM2.5污染較嚴重的問題
采取集中供暖,減少分散供暖,使用清潔能源供暖,減少煤的使用
采取集中供暖,減少分散供暖,使用清潔能源供暖,減少煤的使用
。【考點】常見的生活環境的污染及治理.
【答案】B;SO2+H2O=H2SO3;2H2SO3+O2=2H2SO4;B;夏季溫度升高,氣體的體積增大,有利于反應向體積減小的方向移動,SO2更有利于轉化為(NH4)2SO4,而NH4NO3和HNO3加熱或光照均易分解,夏天溫度較高,光照充足,更有利于NH4NO3和HNO3分解,NO2含量增大;b;采取集中供暖,減少分散供暖,使用清潔能源供暖,減少煤的使用
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:6引用:1難度:0.5
相似題
-
1.“三效催化轉換器”可將汽車尾氣中的有毒氣體處理為無污染的氣體,如圖為該反應的微觀示意圖(未配平),其中不同符號的球代表不同種原子.下列說法正確的是( )
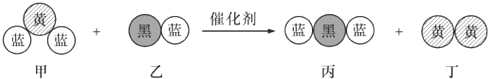
A.該反應屬于置換反應 B.化學方程式中乙、丙的化學計量數均為4 C.甲和丁中同種元素化合價相等 D.甲和丙中所含元素種類相同 發布:2024/12/30 10:30:1組卷:9引用:2難度:0.9 -
2.大氣中CO2含量的增加會加劇“溫室效應”。下列活動會導致大氣中CO2含量增加的是( )
A.燃燒煤炭供熱 B.利用風力發電 C.增加植被面積 D.節約用電用水 發布:2024/12/30 3:0:4組卷:713引用:6難度:0.9 -
3.C、N、S的氧化物中許多是工業上重要的化工原料,但是當它們分散到空氣中時,會帶來很多環境問題。下列有關這些元素的氧化物的說法不正確的是( )
A.開發利用太陽能、水能、風能、氫能等新能源有利于減少這些氧化物的產生 B.這些氧化物使雨水的pH<7,我們把pH<7的雨水稱為酸雨 C.N與S的氧化物能直接危害人體健康,引發呼吸道疾病 D.“溫室效應”與二氧化碳的排放有著直接的關系 發布:2024/12/30 6:0:2組卷:16引用:4難度:0.6


