鈣銅合金可用作電解法制備金屬鈣的陰極電極材料。回答下列問題:
(1)銅在元素周期表中位于dsds(填“s”、“p”、“d”或“ds”)區。
(2)基態Ca原子的價電子排布式為4s24s2。Co與Ca位于同一周期,且最外層電子數相同,但金屬Co的熔點、沸點均比金屬Ca的高,原因是Co原子半徑小,金屬鍵強Co原子半徑小,金屬鍵強。
(3)硫酸銅稀溶液呈藍色,則硫酸銅稀溶液中不存在的作用力有BB(填標號),其中硫酸根的空間構型為正四面體正四面體。
A.配位鍵 B.金屬鍵 C.共價鍵 D.氫鍵 E.范德華力
(4)Cu的一種配位化合物(Me為-CH3)的結構如圖所示,其中Cu的配位數為66,碳原子的雜化類型為sp2、sp3sp2、sp3,C、N、O的第一電離能從小到大的順序是C<O<NC<O<N(填元素符號)。

(5)一種鈣銅合金的結構如圖(Ⅲ可看作是由Ⅰ、Ⅱ兩種原子層交替堆積排列而形成的,其晶胞結構為Ⅳ)。

該鈣銅合金中銅原子與鈣原子的個數比為5:15:1;晶體的坐標系稱為晶軸系,晶軸系以晶胞參數為晶軸的單位向量如圖(Ⅳ),在圖中畫出圖(Ⅳ)中Cu原子沿z軸方向向x-y平面投影的位置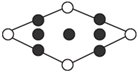
 (用“
(用“ ”表示銅原子)。
”表示銅原子)。


【答案】ds;4s2;Co原子半徑小,金屬鍵強;B;正四面體;6;sp2、sp3;C<O<N;5:1;

【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:60引用:2難度:0.6
相似題
-
1.金屬冶煉和處理常涉及氧化還原反應。
(1)由下列物質冶煉相應金屬時采用電解法的是
a.Fe2O3b.NaCl c.Cu2S d.Al2O3
(2)輝銅礦(Cu2S)可用于火法煉銅:Cu2S+O22Cu+SO2,該反應的氧化劑是高溫,當1mol O2發生反應時,還原劑所失電子的物質的量為mol。
(3)用鋁粉和Fe2O3做鋁熱反應實驗,需要的試劑還有。
a.KCl b.KClO3 c.MnO2 d.Mg
書寫出鋁熱反應的方程式:。
(4)反應TiCl4+2Mg2MgCl2+Ti在氬氣中進行的理由是:高溫。發布:2024/12/6 8:0:2組卷:155引用:1難度:0.5 -
2.下列有關金屬或合金的說法中不正確的是( )
A.生鐵屬于合金 B.金屬的冶煉過程通常是把金屬陽離子還原成單質的過程 C.回收廢舊金屬既可以治理污染,又可以緩解資源短缺 D.工業上電解氧化鎂獲得金屬鎂 發布:2025/1/1 8:0:2組卷:11引用:1難度:0.9 -
3.下列關于金屬冶煉的說法正確的是( )
A.由于Al的活潑性強,故工業上采用電解熔融AlCl3的方法生產Al B.可以用鈉加入氯化鎂溶液中制取鎂 C.煉鐵高爐中所發生的反應都是放熱的,故無需加熱 D.金屬冶煉的方法由金屬的活潑性決定 發布:2025/1/6 6:0:5組卷:31引用:1難度:0.6


