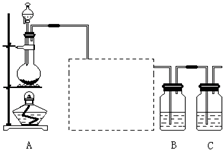
 已知非金屬單質硫(S)是淡黃色固體粉末,難溶于水。為了驗證氯元素的非金屬性比硫元素的非金屬性強,某化學實驗小組設計了如下實驗,請回答下列問題:
已知非金屬單質硫(S)是淡黃色固體粉末,難溶于水。為了驗證氯元素的非金屬性比硫元素的非金屬性強,某化學實驗小組設計了如下實驗,請回答下列問題:
(1)裝置A的分液漏斗中盛裝的試劑是濃鹽酸濃鹽酸,燒瓶中加入的試劑是MnO2MnO2。
(2)畫出虛線框內的實驗裝置圖,并注明所加試劑,
 說明裝置的作用除去Cl2中的HCl氣體除去Cl2中的HCl氣體。
說明裝置的作用除去Cl2中的HCl氣體除去Cl2中的HCl氣體。
(3)裝置B中盛放的試劑是AA(選填下列所給試劑的代碼),實驗現象為有淡黃色沉淀生成有淡黃色沉淀生成,化學反應方程式是Na2S+Cl2=2NaCl+S↓Na2S+Cl2=2NaCl+S↓,該反應屬于四種基本反應類型中的置換置換反應。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)從原子結構的角度簡要分析氯元素的非金屬性比硫元素的非金屬性強的原因。
Cl原子、S原子的電子層數相同,但最外層電子數Cl原子是7,S原子是6,且原子半徑Cl<S,因此,在反應中Cl原子比S原子更容易獲得電子達穩定結構,故氯元素的非金屬性比硫元素的非金屬性強。Cl原子、S原子的電子層數相同,但最外層電子數Cl原子是7,S原子是6,且原子半徑Cl<S,因此,在反應中Cl原子比S原子更容易獲得電子達穩定結構,故氯元素的非金屬性比硫元素的非金屬性強。
(5)還有哪些事實能夠說明氯元素的非金屬性比硫元素的非金屬性強(試舉一例)。
HCl的穩定性比H2S的穩定性強或者HClO4的酸性比H2SO4的酸性強。(其他合理答案均可)HCl的穩定性比H2S的穩定性強或者HClO4的酸性比H2SO4的酸性強。(其他合理答案均可)
(6)裝置C中盛放燒堿溶液,目的是吸收反應后剩余的氣體,防止污染空氣。在該反應中,Cl元素的化合價既有升高又有降低,即在反應中Cl元素的原子既能獲得電子也能失去電子,能否說氯元素既具有金屬性又具有非金屬性?簡述你的理由。
不能不能
金屬性強弱的判斷以元素的單質與水(或酸)反應置換氫的難易程度,以及它的最高價氧化物的水化物的堿性強弱為依據。非金屬性的強弱以它與氫氣生成氫化物的穩定性或它的最高價氧化物的水化物的酸性強弱來判斷。(其他合理答案均可)金屬性強弱的判斷以元素的單質與水(或酸)反應置換氫的難易程度,以及它的最高價氧化物的水化物的堿性強弱為依據。非金屬性的強弱以它與氫氣生成氫化物的穩定性或它的最高價氧化物的水化物的酸性強弱來判斷。(其他合理答案均可)。


【答案】濃鹽酸;MnO2; ;除去Cl2中的HCl氣體;A;有淡黃色沉淀生成;Na2S+Cl2=2NaCl+S↓;置換;Cl原子、S原子的電子層數相同,但最外層電子數Cl原子是7,S原子是6,且原子半徑Cl<S,因此,在反應中Cl原子比S原子更容易獲得電子達穩定結構,故氯元素的非金屬性比硫元素的非金屬性強。;HCl的穩定性比H2S的穩定性強或者HClO4的酸性比H2SO4的酸性強。(其他合理答案均可);不能;金屬性強弱的判斷以元素的單質與水(或酸)反應置換氫的難易程度,以及它的最高價氧化物的水化物的堿性強弱為依據。非金屬性的強弱以它與氫氣生成氫化物的穩定性或它的最高價氧化物的水化物的酸性強弱來判斷。(其他合理答案均可)
;除去Cl2中的HCl氣體;A;有淡黃色沉淀生成;Na2S+Cl2=2NaCl+S↓;置換;Cl原子、S原子的電子層數相同,但最外層電子數Cl原子是7,S原子是6,且原子半徑Cl<S,因此,在反應中Cl原子比S原子更容易獲得電子達穩定結構,故氯元素的非金屬性比硫元素的非金屬性強。;HCl的穩定性比H2S的穩定性強或者HClO4的酸性比H2SO4的酸性強。(其他合理答案均可);不能;金屬性強弱的判斷以元素的單質與水(或酸)反應置換氫的難易程度,以及它的最高價氧化物的水化物的堿性強弱為依據。非金屬性的強弱以它與氫氣生成氫化物的穩定性或它的最高價氧化物的水化物的酸性強弱來判斷。(其他合理答案均可)
 ;除去Cl2中的HCl氣體;A;有淡黃色沉淀生成;Na2S+Cl2=2NaCl+S↓;置換;Cl原子、S原子的電子層數相同,但最外層電子數Cl原子是7,S原子是6,且原子半徑Cl<S,因此,在反應中Cl原子比S原子更容易獲得電子達穩定結構,故氯元素的非金屬性比硫元素的非金屬性強。;HCl的穩定性比H2S的穩定性強或者HClO4的酸性比H2SO4的酸性強。(其他合理答案均可);不能;金屬性強弱的判斷以元素的單質與水(或酸)反應置換氫的難易程度,以及它的最高價氧化物的水化物的堿性強弱為依據。非金屬性的強弱以它與氫氣生成氫化物的穩定性或它的最高價氧化物的水化物的酸性強弱來判斷。(其他合理答案均可)
;除去Cl2中的HCl氣體;A;有淡黃色沉淀生成;Na2S+Cl2=2NaCl+S↓;置換;Cl原子、S原子的電子層數相同,但最外層電子數Cl原子是7,S原子是6,且原子半徑Cl<S,因此,在反應中Cl原子比S原子更容易獲得電子達穩定結構,故氯元素的非金屬性比硫元素的非金屬性強。;HCl的穩定性比H2S的穩定性強或者HClO4的酸性比H2SO4的酸性強。(其他合理答案均可);不能;金屬性強弱的判斷以元素的單質與水(或酸)反應置換氫的難易程度,以及它的最高價氧化物的水化物的堿性強弱為依據。非金屬性的強弱以它與氫氣生成氫化物的穩定性或它的最高價氧化物的水化物的酸性強弱來判斷。(其他合理答案均可)【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:37引用:3難度:0.5
相似題
-
1.甲、乙兩種非金屬元素:①甲單質比乙單質容易與H2化合;②甲單質能與乙的陰離子發生置換反應;③甲的最高價氧化物對應的水化物酸性比乙的最高價氧化物對應的水化物酸性強;④與某金屬反應時,甲原子得電子數目比乙的多;⑤甲的單質水溶性比乙的強。能說明甲比乙的非金屬性強的是( )
A.④ B.⑤ C.①②③ D.①②③④ 發布:2024/12/30 19:30:2組卷:33引用:3難度:0.8 -
2.下列事實不能說明氯的非金屬性強于硫的是( )
A.酸性:HClO3>H2SO3 B.穩定性:HCl>H2S C.3Cl2+2Fe 2FeCl3和S+Fe點燃FeS△D.Cl2+H2S=S↓+2HCl 發布:2024/12/30 18:0:1組卷:24引用:4難度:0.5 -
3.碳、氧、硅、鍺、氟、氯、溴、鎳元素在化學中占有極其重要的地位。
(1)第二周期基態原子未成對電子數與Ni相同且電負性最小的元素是。
(2)從電負性角度分析,碳,氧和硅元素的非金屬性由強至弱的順序為。
(3)CH4中共用電子對偏向C,SiH4中共用電子對偏向H,則C、Si、H的電負性由大到小的順序為。
(4)基態鍺(Ge)原子的電子排布式是,Ge的最高價氯化物分子式是。該元素可能的性質或應用有(填字母)。
A.是一種活潑的金屬元素
B.其電負性大于硫
C.其單質可作為半導體材料
D.鍺的第一電離能高于碳而電負性低于碳
(5)溴與氯能以鍵結合形成BrCl,BrCl分子中,顯正電性。BrCl與水發生反應的化學方程式為。發布:2024/12/30 15:30:1組卷:72引用:5難度:0.5


