小聰同學(xué)家新?lián)Q了水龍頭,從說明書上了解到該水龍頭是銅質(zhì)鍍鉻。好奇的小聰想探究鉻(Cr)與常見金屬鐵、銅的活動性強弱,邀請你一同參加。
[知識回放]
金屬活動性順序:K Ca Na Mg Al Zn Fe Sn Pb(H) CuCu Hg Ag Pt Au,請你在橫線上填寫對應(yīng)金屬的元素符號。
[作出猜想]
猜想1:Cr>Fe>Cu;猜想2:Fe>Cu>Cr;猜想3:你的猜想是 Fe>Cr>CuFe>Cr>Cu。
[查閱資料]
(1)鉻是銀白色有光澤的金屬,在空氣中其表面能生成抗腐蝕的致密的氧化膜。
(2)鉻能與稀硫酸反應(yīng),生成藍色的硫酸亞鉻(CrSO4)溶液。
[設(shè)計實驗]
小聰同學(xué)取大小相等的三種金屬片,用砂紙打磨光亮;再取三支試管,分別放入等量的同種稀硫酸。
| 實驗 | 試管1 | 試管2 | 試管3 |
| 實驗 操作 |
 |
 |
 |
| 實驗 現(xiàn)象 |
鐵片表面產(chǎn)生氣泡較慢,溶液變?yōu)闇\綠色 | 鉻片表面產(chǎn)生氣泡較快,溶液變成為藍色 |
銅片表面不產(chǎn)生氣泡 銅片表面不產(chǎn)生氣泡
|
(1)小聰?shù)玫降慕Y(jié)論是猜想
1
1
正確。(2)實驗前用砂紙打磨金屬片的目的是
除去金屬表面的氧化物
除去金屬表面的氧化物
。[知識運用]
將鉻片投入FeSO4溶液中,反應(yīng)
能
能
(填“能”或“不能”)進行。若能進行,請你寫出反應(yīng)的化學(xué)方程式 Cr+FeSO4=CrSO4+Fe
Cr+FeSO4=CrSO4+Fe
。【答案】Cu;Fe>Cr>Cu;銅片表面不產(chǎn)生氣泡;1;除去金屬表面的氧化物;能;Cr+FeSO4=CrSO4+Fe
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/9/13 3:0:11組卷:170引用:3難度:0.3
相似題
-
1.根據(jù)圖示設(shè)計的實驗來進一步認識金屬的化學(xué)性質(zhì)和金屬的活動性順序。
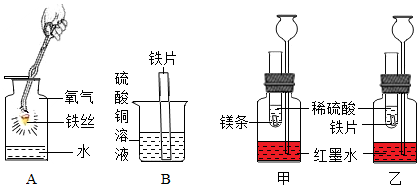
(1)寫出實驗A中反應(yīng)的化學(xué)方程式:。
(2)實驗B中可觀察到鐵片的表面出現(xiàn),說明鐵的金屬活動性比銅(填“強”或“弱”)。
(3)若想探究鎂、鐵、銅三種金屬的活動性強弱,小清同學(xué)提出在實驗B的基礎(chǔ)上增加實驗甲和乙,便可得出結(jié)論。試管內(nèi)的鎂片和鐵片表面均被打磨潔凈,且形狀、大小相同;同時加入等質(zhì)量和等濃度的稀硫酸。
①乙裝置中發(fā)生反應(yīng)的化學(xué)方程式為。
②觀察到試管中有氣泡產(chǎn)生且長頸漏斗中甲的液面上升比乙(填“快”或“慢”)時,可以證明鎂的金屬活動性比鐵的強。
③若甲、乙實驗所用的金屬均過量,則甲裝置中產(chǎn)生的H2質(zhì)量(填“大于”“小于”或“等于”)乙裝置中產(chǎn)生的H2質(zhì)量。
④小亮同學(xué)指出若想探究這三種金屬的活動性強弱,只需使用三種藥品即可達到實驗?zāi)康模埬銕椭×镣瓿善鋵嶒灧桨浮?br />操作 現(xiàn)象 結(jié)論 將鎂片和銅片分別放入氯化亞鐵溶液中 放入銅片的氯化亞鐵溶液中 ,放入鎂片的氯化亞鐵溶液的顏色由金屬的活動性強弱關(guān)系為Mg>Fe>Cu 發(fā)布:2024/12/7 8:0:1組卷:77引用:1難度:0.5 -
2.2019年版第五套人民幣5角硬幣的材質(zhì)已由“鋼芯鍍銅合金”改為“鋼芯鍍鎳”,其表面色澤也因此由
色變?yōu)殂y白色。化學(xué)興趣小組決定,探究制造5角硬幣的三種主要金屬(鐵、銅、鎳)活動性順序。
【查閱資料】
(1)硫酸鎳溶液顯綠色,Ni的化合價通常為+2價。
(2)鎳能與稀硫酸反應(yīng),生成硫酸鎳和氫氣。
【提出猜想】猜想①:;猜想②:Fe>Ni>Cu。
【實驗探究】
(1)甲組同學(xué)將一塊表面潔凈的鎳片放入稀硫酸中,觀察到的實驗現(xiàn)象是,有關(guān)反應(yīng)的化學(xué)方程式是。
(2)乙組同學(xué)將一塊表面潔凈的鎳片浸入硫酸亞鐵溶液中,一會兒取出,發(fā)現(xiàn)鎳片表面無明顯變化,說明猜想(填“①”或“②”)成立。
(3)丙組同學(xué)用銅片、硫酸鎳溶液和進行實驗,也得出了三種金屬的活動性順序。
【拓展延伸】
(1)某電鍍公司的檢修員利用工作之便,將鎳網(wǎng)放入含有金鹽的電鍍液中偷偷“吸取”黃金,該盜竊手法利用了(填反應(yīng)的基本類型)原理。該員工竊取貴重物品的行為,必將受到法律的制裁。
(2)金屬活動性實際上是金屬在水溶液中失去電子的能力大小。下列事實可以判斷M、N兩種金屬活動性順序的是(填序號)。
①M能和鹽酸反應(yīng)而N不能
②M、N分別放入鹽酸中比較反應(yīng)劇烈程度
③常溫下M能與氧氣反應(yīng)而N不能
④M能從N的鹽溶液中置換出N發(fā)布:2024/12/25 14:0:2組卷:229引用:5難度:0.5 -
3.化學(xué)小組為探究鐵、銅、鋅、銀的金屬活動性順序,設(shè)計如下三個實驗(其中金屬均已打磨,其形狀、大小及同種稀鹽酸的用量均相同):
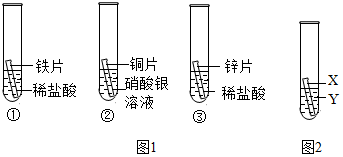
(1)實驗①的化學(xué)方程式為;一段時間后,觀察到實驗②的銅片表面有銀白色固體附著,這說明銅比銀的活動性(填“強”或“弱”)。
(2)甲同學(xué)認為通過實驗①和③可比較鋅和鐵的金屬活動性,他依據(jù)的實驗現(xiàn)象是。
(3)乙、丙兩位同學(xué)認為上述實驗方案不足以得出四種金屬的活動順序,并在上述實驗的基礎(chǔ)上,利用金屬
不同的化學(xué)性質(zhì)分別補充了一個實驗(圖2所示),都實現(xiàn)了探究的目的。乙同學(xué)的實驗:X是金屬,Y是溶液;丙同學(xué)的實驗:X是金屬,Y是溶液。發(fā)布:2024/12/25 17:30:2組卷:46引用:4難度:0.5


