實驗室用如圖裝置制取氧氣。

實驗一:用氯酸鉀和二氧化錳的混合物制取氧氣
①儀器x的名稱是 鐵架臺鐵架臺。
②加熱氯酸鉀和二氧化錳混合物制取氧氣的化學方程式為 2KClO3MnO2△2KCl+3O2↑2KClO3MnO2△2KCl+3O2↑。
③取用氯酸鉀的儀器是 DD。

④如圖一所示,加熱氯酸鉀和二氧化錳的混合物,水槽中導管口無氣泡產(chǎn)生,可能的原因 AA。
A.裝置的氣密性不好,最多可能有4處漏氣
B.加熱的溫度還未達到氯酸鉀分解的溫度
C.導管未放入集氣瓶中
D.試管底部沒有均勻受熱
⑤利用裝置C收集氧氣,氣體應從m端進入,理由是 氧氣密度比空氣大氧氣密度比空氣大。
⑥實驗結(jié)束時,應先將導管移出水槽再熄滅酒精燈,目的是 防止水倒流引起試管爆裂防止水倒流引起試管爆裂。
實驗二:探究H2O2的質(zhì)量分數(shù)對分解速率的影響
如圖二所示,分別用注射器加入不同濃度的H2O2溶液(見下表),使用傳感器測燒瓶中O2的濃度(燒瓶內(nèi)氣壓變化在安全范圍),繪制氧氣濃度隨時間變化的曲線。
M
n
O
2
△
M
n
O
2
△
| 試驗編號 | H2O2的質(zhì)量分數(shù)(%) | H2O2溶液的體積(mL) | 對應曲線 |
| Ⅰ | 3.4 | 10.0 | a |
| Ⅱ | 2.4 |
10.0 10.0
|
b |
| Ⅲ | 1.7 | 10.0 | c(待繪制) |
②從曲線a、b中,可得出的結(jié)論是
其它條件相同時,過氧化氫溶液質(zhì)量分數(shù)越大,反應速率越快
其它條件相同時,過氧化氫溶液質(zhì)量分數(shù)越大,反應速率越快
。③在圖中畫出曲線c的位置及趨勢。
④某過氧化氫溶液中含4mol過氧化氫,理論上完全分解可以生成多少克氧氣?(根據(jù)化學方程式列式計算)
【答案】鐵架臺;2KClO32KCl+3O2↑;D;A;氧氣密度比空氣大;防止水倒流引起試管爆裂;10.0;其它條件相同時,過氧化氫溶液質(zhì)量分數(shù)越大,反應速率越快
M
n
O
2
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:18引用:1難度:0.9
相似題
-
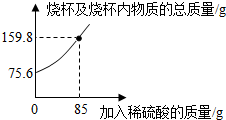 1.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當加稀硫酸質(zhì)量為85g時,反應恰好完全(雜質(zhì)不反應且產(chǎn)生的氣體全部逸出),反應過程中的質(zhì)量關系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當加稀硫酸質(zhì)量為85g時,反應恰好完全(雜質(zhì)不反應且產(chǎn)生的氣體全部逸出),反應過程中的質(zhì)量關系如圖.完成下列問題:
(1)該實驗取用的樣品質(zhì)量為g.
(2)計算樣品中鐵的質(zhì)量分數(shù)(寫出解題過程).發(fā)布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
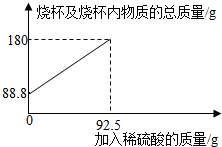 2.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關系如圖。
2.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關系如圖。
(1)該實驗取用的樣品質(zhì)量為g。
(2)反應后所得溶液中的溶質(zhì)的質(zhì)量分數(shù)。(寫出計算過程,結(jié)果保留一位小數(shù))
(3)反應結(jié)束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
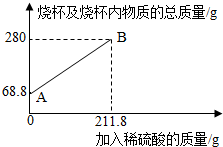 3.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關系如圖。
3.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關系如圖。
(1)該實驗取用的樣品質(zhì)量為g。
(2)求樣品中鐵的質(zhì)量分數(shù);反應后所得溶液中的溶質(zhì)的質(zhì)量分數(shù)。(寫出計算過程,結(jié)果保留一位小數(shù))
(3)反應結(jié)束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


