用如圖所示裝置進行實驗,回答下列問題。

(1)裝置Ⅰ的實驗目的是 測定空氣中的氧氣含量測定空氣中的氧氣含量。能否用硫磺代替本實驗中的紅磷?不能不能。
(2)Ⅱ中電解反應的化學方程式為 2H2O 通電 2H2↑+O2↑2H2O 通電 2H2↑+O2↑;該實驗得到的直接結論是 水是由氫元素和氧元素組成水是由氫元素和氧元素組成。
(3)完成圖Ⅲ所示實驗時,應先 通CO通CO(選填“通 CO”或“點燃酒精噴燈”),試管中發生反應的化學方程式為 CO+CuO △ Cu+CO2CO+CuO △ Cu+CO2,尾部的酒精燈處發生的反應屬于什么基本反應類型?化合反應化合反應。同學們在實驗前后均進行了準確稱量,發現實驗后玻璃管及其內容物的質量減小了0.8g,則他們理論上可以得到 3.23.2 g銅。
通電
通電
△
△
【考點】碳、一氧化碳、氫氣還原氧化銅實驗.
【答案】測定空氣中的氧氣含量;不能;2H2O 2H2↑+O2↑;水是由氫元素和氧元素組成;通CO;CO+CuO Cu+CO2;化合反應;3.2
通電
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/12/17 4:30:2組卷:34引用:1難度:0.5
相似題
-
1.用甲乙丙三套裝置進行H2、C、CO還原CuO的實驗并檢驗產物(已知白色粉末無水硫酸銅遇水變藍色)、分析上述三個實驗,下列說法錯誤的是( )
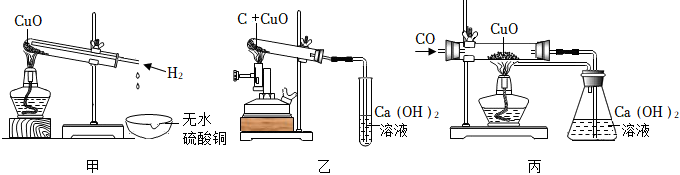
A.甲乙丙三個實驗都能觀察到黑色粉末變紅色的現象,并能成功檢驗產物 B.甲乙丙三個反應中,反應前后Cu元素的化合價都降低,O元素的化合價都不變 C.甲乙丙三個實驗能說明H2、C、CO都具有還原性,且三個反應都是置換反應 D.若反應前稱量丙中硬質玻璃管及氧化銅的總質量為60g,通入一氧化碳反應一段時間后,冷卻稱量硬質玻璃管及其中物質的總質量為58.4g,則參加反應的氧化銅的質量為8g 發布:2024/12/28 12:30:2組卷:70引用:2難度:0.5 -
2.研究性學習小組的同學用氫氣還原氧化銅的原理測定水的組成。請你一起對此展開探究。

【設計方案】
甲同學利用如圖裝置及藥品進行實驗,洗氣瓶B中濃硫酸的作用是。
【實驗探究】
當玻璃管中固體由黑色轉變為紅色時,實驗測得:
①裝置C的玻璃管和其中固體的總質量在反應后減少了1.6g;
②裝置D的干燥管和其中物質的總質量在反應后增加了1.82g,用此數據算得水中H、O元素的質量比為,而由水的化學式計算得出H、O元素的質量比為1:8。
【分析交流】
假設裝置內原有空氣中的水蒸氣、CO2已預先排盡,生成的水完全被D中堿石灰吸收。針對上述實驗結果與理論值有偏差,乙同學認為:該裝置存在缺陷,應在D裝置后,再連接一個盛堿石灰的干燥管,增加該裝置的作用是。小組同學用改進后的裝置重新實驗得到了正確結果。發布:2024/12/13 20:0:2組卷:431引用:9難度:0.5 -
3.某氣體可能由H2、CO、CO2、H2O、HCl中的一種或幾種組成,為確定其成分,進行如下實驗:

氣體通過有關裝置時觀察到的現象如下:
試推斷:裝置編號 A B C D E 試劑 硝酸銀溶液 澄清石灰水 氧化銅粉末 澄清石灰水 無水硫酸銅 現象 無明顯變化 變渾濁 變紅色 無明顯變化 變藍色
(1)裝置A的作用是。
(2)根據上表中的現象判斷該氣體中一定含有。
(3)若想證明該氣體的確切成分、應如何改進裝置?寫出具體改進方案。發布:2024/12/28 15:30:1組卷:113引用:2難度:0.5


