當(dāng)前位置:
試題詳情
( 1)比較離子半徑:F-小于小于(填“大于”“等于”或“小于”)O2-。
(2)Li+與H-具有相同的電子結(jié)構(gòu),r(Li+)小于r(H-),原因是 H-核電荷數(shù)更小(或Li+核電荷數(shù)較大)H-核電荷數(shù)更小(或Li+核電荷數(shù)較大)。
(3)NH3BH3分子中,與N原子相連的H呈正電性(Hδ+),與B原子相連的H呈負(fù)電性(Hδ-),N、B、H三種元素電負(fù)性大小順序是 N>H>BN>H>B。
(4)光催化還原CO2制備CH4反應(yīng)中,帶狀納米 Zn2GeO4是該反應(yīng)的良好催化劑。Zn、Ge、O電負(fù)性由大至小的順序是 O>Ge>ZnO>Ge>Zn。
(5)在周期表中,與Li的化學(xué)性質(zhì)最相似的鄰族元素是 MgMg。
(6)下列狀態(tài)的鎂中,電離最外層一個電子所需能量最大的是 AA(填字母)。
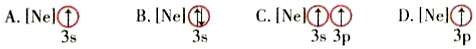
(7)黃銅是人類最早使用的合金之一,主要由Zn和 Cu組成。第一電離能I1(Zn) 大于大于(填“大于”或“小于”)I1(Cu)。原因是 Zn的3d能級與4s能級為全滿穩(wěn)定結(jié)構(gòu),較難失電子Zn的3d能級與4s能級為全滿穩(wěn)定結(jié)構(gòu),較難失電子。
(8)I1(Li)>I1(Na),原因是 Na與Li同主族,Na的電子層數(shù)更多,原子半徑更大,第一電離能更小Na與Li同主族,Na的電子層數(shù)更多,原子半徑更大,第一電離能更小。I1(Be)>I1(B)>I1(Li),原因 Li、Be和B為同周期元素,同周期元素從左至右,第一電離能呈現(xiàn)增大的趨勢,但由于基態(tài)Be原子的s能級軌道處于全充滿狀態(tài),能量更低更穩(wěn)定,其第一電離能大于BLi、Be和B為同周期元素,同周期元素從左至右,第一電離能呈現(xiàn)增大的趨勢,但由于基態(tài)Be原子的s能級軌道處于全充滿狀態(tài),能量更低更穩(wěn)定,其第一電離能大于B。
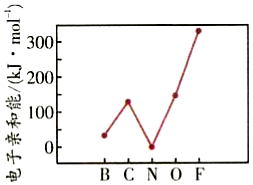
(9)元素的基態(tài)氣態(tài)原子得到一個電子形成氣態(tài)負(fù)一價離子時所放出的能量稱作第一電子親和能(E1)。第2周期部分元素的E1變化趨勢如圖所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是同周期元素隨核電荷數(shù)增大,原子半徑逐漸減小,原子核對電子的吸引能力越強(qiáng),故結(jié)合一個電子釋放的能量依次增大同周期元素隨核電荷數(shù)增大,原子半徑逐漸減小,原子核對電子的吸引能力越強(qiáng),故結(jié)合一個電子釋放的能量依次增大;氮元素的E1呈現(xiàn)異常的原因是 N元素原子2p軌道為半充滿穩(wěn)定狀態(tài),不易結(jié)合一個電子N元素原子2p軌道為半充滿穩(wěn)定狀態(tài),不易結(jié)合一個電子。
【答案】小于;H-核電荷數(shù)更小(或Li+核電荷數(shù)較大);N>H>B;O>Ge>Zn;Mg;A;大于;Zn的3d能級與4s能級為全滿穩(wěn)定結(jié)構(gòu),較難失電子;Na與Li同主族,Na的電子層數(shù)更多,原子半徑更大,第一電離能更小;Li、Be和B為同周期元素,同周期元素從左至右,第一電離能呈現(xiàn)增大的趨勢,但由于基態(tài)Be原子的s能級軌道處于全充滿狀態(tài),能量更低更穩(wěn)定,其第一電離能大于B;同周期元素隨核電荷數(shù)增大,原子半徑逐漸減小,原子核對電子的吸引能力越強(qiáng),故結(jié)合一個電子釋放的能量依次增大;N元素原子2p軌道為半充滿穩(wěn)定狀態(tài),不易結(jié)合一個電子
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/12/30 18:0:1組卷:21引用:2難度:0.3
相似題
-
1.關(guān)于微粒半徑大小的下列敘述中不正確的是( )
A.同一元素的不同微粒,核外電子數(shù)越多,半徑越大 B.同一元素形成的多種價態(tài)的離子,價態(tài)越低,半徑越小 C.同一元素的原子半徑小于相應(yīng)的陰離子半徑 D.同一元素的原子半徑大于相應(yīng)的陽離子半徑 發(fā)布:2024/12/30 18:0:1組卷:16引用:2難度:0.6 -
2.下列粒子的半徑關(guān)系正確的是( )
A.r(Na)>r(Mg)>r(Al)>r(K) B.r(K +)>r(Ca 2+)>r(S 2-)>r(Cl -) C.r(Na)>r(K)>r(Ca)>r(Mg) D.r(F -)>r(Na +)>r(Mg 2+)>r(Al 3+) 發(fā)布:2024/12/30 17:0:2組卷:98引用:3難度:0.7 -
3.下列離子半徑的大小順序正確的是( )
①Na+
②X2-:1s22s22p63s23p6
③Y2-:2s22p6
④Z-:3s23p6A.③>④>②>① B.④>③>②>① C.④>③>①>② D.②>④>③>① 發(fā)布:2024/12/30 18:30:1組卷:16引用:7難度:0.6


