為改善傳統肥皂洗滌效果差、使用范圍小等缺點,在綠色化學前提下,將肥皂與香皂的油脂配方相結合,確定最佳油脂比例,研制出了某新型肥皂,其部分流程如圖1:
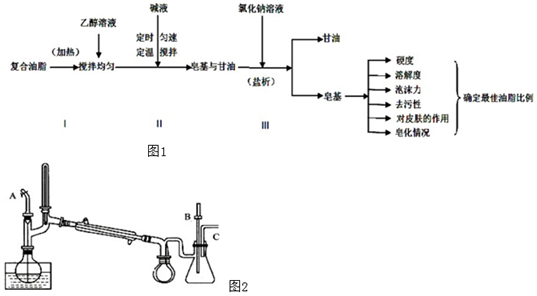
請回答:
(1)描述步驟Ⅰ中檢驗油脂已完全反應的方法 用玻璃棒蘸取反應液,滴入裝有熱水的試管中,振蕩,若無油滴浮在液面上,說明油脂已反應完全用玻璃棒蘸取反應液,滴入裝有熱水的試管中,振蕩,若無油滴浮在液面上,說明油脂已反應完全。
(2)將皂化尾液滴入新制的氫氧化銅懸濁液中會出現絳藍色,寫出化學方程式 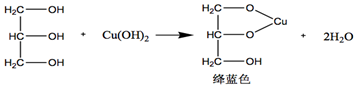
 。
。
(3)下列操作或描述正確的是 BDEBDE。
A.步驟Ⅰ中的復合油脂主要是牛油,地溝油和廢棄的汽車機油經處理后也可作原料。
B.步驟Ⅱ肯定不會用到的兩種儀器是容量瓶和研缽。
C.步驟Ⅲ“分離”可用紗布濾出下層固態物質并將其瀝干,這與過濾相似,也是一種固液分離的方法。
D.蒸餾相對于其它的分離方法,比如萃取、結晶、過濾等,它的優點在于不需要使用系統組分以外的其它溶劑,從而保證不會引入新的雜質。
E.新型肥皂不適宜在海水、酸性水中使用。
(4)興趣小組成員們采用如圖2裝置從皂化尾液中分離提純甘油,C處連接抽氣泵。按正確的操作順序選擇下列的所有步驟補充完整:按圖示連接裝置→旋緊毛細管上的螺旋夾A→關閉安全瓶上的活塞B調好真空度后抽氣→接通冷凝水→c→d→a→b→ec→d→a→b→e→關閉真空泵→拆除儀器。(每個步驟只用一次)
a.移去熱源等待冷卻
b.關閉冷凝水
c.給蒸餾燒瓶加熱
d.收集甘油
e.打開活塞B
(5)步驟Ⅱ中堿液的濃度,很難配制準確,實驗前常用鄰苯二甲酸氫鉀(M=204g?mol-1)來進行標定。配制約為0.1mol?L-1的NaOH標準溶液。精確稱取鄰苯二甲酸氫鉀(m/g)三份,放入三個錐形瓶中加水溶解,加入2滴酚酞指示劑,用待標定的NaOH標準溶液滴至終點,記錄所消耗的NaOH標準溶液的體積(V/mL)。實驗測定相關數據如下:


| 第一次 | 第二次 | 第三次 | |
| m/g | 0.511 | 0.509 | 0.510 |
| V/mL | 22.51 | 22.49 | 22.50 |
0.111
0.111
mol?L-1。其中鄰苯二甲酸氫鉀的質量m的范圍最適宜的是 C
C
。A、0.2左右
B、0.2~0.4
C、0.4~0.6
D、0.8左右
【答案】用玻璃棒蘸取反應液,滴入裝有熱水的試管中,振蕩,若無油滴浮在液面上,說明油脂已反應完全; ;BDE;c→d→a→b→e;0.111;C
;BDE;c→d→a→b→e;0.111;C
 ;BDE;c→d→a→b→e;0.111;C
;BDE;c→d→a→b→e;0.111;C【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:9引用:1難度:0.5
相似題
-
1.下列實驗方法或操作正確的是( )
A.酸堿中和滴定時,右手旋轉滴定管的活塞,左手搖動錐形瓶,眼睛注視滴定管中的液面 B.用200mL燒杯配制物質的量濃度約為0.1000mol/L氫氧化鈉溶液200mL C.不用另加任何試劑就能鑒別NaAlO2、Na2SiO3、HCl、NaCl四種無色溶液 D.用托盤天平稱取1.6g硫酸銅晶體配制100mL 0.1mol/L的硫酸銅溶液 發布:2024/12/12 8:0:1組卷:9引用:1難度:0.7 -
2.食醋是日常飲食中的一種調味劑,國家標準規定釀造食醋中醋酸含量不得低于0.035g/mL,實驗室用標準NaOH溶液測定食醋中醋酸的濃度,以檢測食醋是否符合國家標準,某品牌白醋的醋酸濃度測定過程如圖所示,請回答:
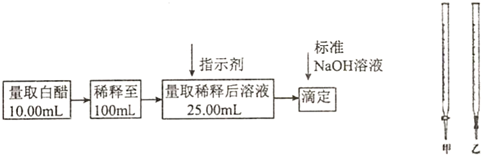
(1)選用上述(填“甲”或“乙”)滴定管量取10.00mL白醋后,將白醋稀釋至100mL時,需要使用的玻璃儀器有燒杯、玻璃棒和.
(2)某同學用酸堿中和滴定法測定該品牌白醋的醋酸濃度,當醋酸與氫氧化鈉恰好完全反應時,測得溶液中=c(CH3COOH)c(CH3COO-),則此時溶液中的pH=11.8×103.(已知:室溫下醋酸的Ka=1.8×10-5)
(3)根據該同學的計算結果,應該選作指示劑.(填“酚酞”、“甲基橙”或“石蕊”)
(4)該滴定達到終點時的現象是.
(5)某次實驗滴定開始和結束時,堿式滴定管中的液面如下圖所示,則所用NaOH溶液的體積為mL.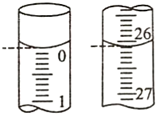
(6)用標準的0.06000mol?L-1NaOH溶液滴定上述稀釋后的醋酸溶液,滴定結果如下表所示:
則該品牌白醋中醋酸含量為滴定次數 待測溶液的體積/mL 標準溶液的體積 滴定前刻度/mL 滴定后刻度/mL 1 25.00mL 0.02 25.01 2 25.00mL 0.70 25.71 3 25.00mL 0.50 24.2 mg/mL.
(7)下列操作中,可能使所測白醋中醋酸的濃度數值偏高的是.(填編號)
A.取待測液的滴管,取液前滴定管尖嘴處無氣泡,取液后尖嘴處出現氣泡
B.滴定前盛放白醋稀溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.堿式滴定管未用標準NaOH溶液潤洗就直接注入標準NaOH溶液
D.讀取NaOH溶液體積時,開始時俯視讀數,滴定結束時仰視讀數
(8)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度處,現把管內液體全部放出,用量筒接收,得到溶液的體積是.
A.等于10mL
B.等于40mL
C.大于40mL
D.不能確定發布:2024/12/30 3:0:4組卷:54引用:2難度:0.6 -
3.下面關于中和滴定的實驗操作敘述不正確的有( )
①將錐形瓶用蒸餾水和待測定的鹽酸溶液進行洗滌
②取20mL待測定的鹽酸溶液,注入錐形瓶中
③向錐形瓶中加入幾滴酚酞試液為指示劑
④堿式滴定管用蒸餾水洗滌后,直接注入已知濃度的NaOH溶液
⑤進行中和滴定時,一旦錐形瓶內溶液由無色變成粉紅色,即可停止滴定
⑥記錄數據,進行必要的數據處理和得出結論A.①④⑥ B.①②④ C.①②④⑤ D.②③⑤ 發布:2024/12/10 0:30:1組卷:92引用:2難度:0.7


