氯化鋇是重要的化工原料,以毒重石(主要成分是BaCO3,還含有SiO2和含有Ca、Fe、Mg的化合物)為原料制備BaCl2?2H2O的工藝流程如圖所示。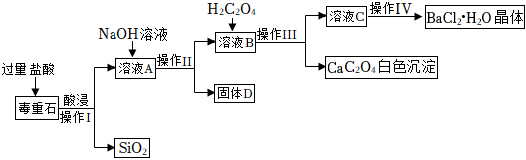
已知:“酸浸”后,含有Ca、Fe、Mg的化合物分別以Ca2+、Fe3+、Mg2+的形式存在于水溶液中。草酸與氯化鋇溶液不反應。
(1)固體D的主要成分是 Mg(OH)2、Fe(OH)3Mg(OH)2、Fe(OH)3。
(2)溶液B中加入的草酸(H2C2O4)是否可以用碳酸鈉溶液代替?并說明理由 不可以,碳酸鈉能和氯化鋇反應生成碳酸鋇白色沉淀,影響產率不可以,碳酸鈉能和氯化鋇反應生成碳酸鋇白色沉淀,影響產率。
(3)實驗室稱取獲得的樣品5g,加入足量的水配成溶液,向其中滴加過量的稀硫酸,過濾、洗滌、干燥,精確稱量沉淀的質量為4.66g。求5g樣品中BaCl2的質量。(寫出計算過程)
(4)“酸浸”過程中,影響鋇離子浸出率(被浸出的百分率)的因素有很多。下表是不同溫度、不同濃度鹽酸下鋇離子的浸出率,每個實驗只改變一個條件。
| 條件 | 溫度/℃ | 鹽酸的濃度/% | |||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | |
| 鋇離子的浸出率/% | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 |
15%
15%
;溫度與鋇離子浸出率的關系為 其他條件相同時,溫度越低,鋇離子的浸出率越高
其他條件相同時,溫度越低,鋇離子的浸出率越高
。【答案】Mg(OH)2、Fe(OH)3;不可以,碳酸鈉能和氯化鋇反應生成碳酸鋇白色沉淀,影響產率;15%;其他條件相同時,溫度越低,鋇離子的浸出率越高
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/5/20 8:0:9組卷:16引用:1難度:0.5
相似題
-
1.新冠肺炎疫情防控期間,西安市各學校開展全域噴灑低濃度、有效成分是次氯酸鈉的“84”消毒液進行消毒。如圖所示是模擬制備“84”消毒液的流程(Cl2是一種黃綠色的有毒氣體)。請回答下列問題:
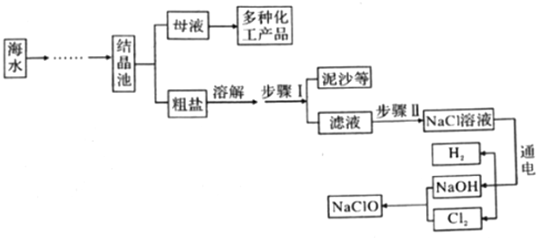
(1)NaOH的俗稱為(寫一種)。
(2)步驟Ⅱ中,通常用碳酸鈉溶液除去濾液中的氯化鈣雜質,請寫出有關反應的化學方程式。
(3)電解水時,一般在水中加入少量NaOH以增強水的導電性,不能加入NaCl的原因是。發布:2025/1/3 8:0:1組卷:6引用:1難度:0.5 -
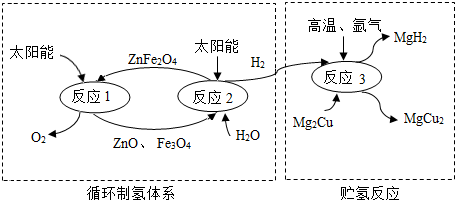 2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )
2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )A.ZnFe2O4中Fe的化合價為+3價 B.循環制氫反應中無需加入ZnFe2O4 C.反應1和反應2的總方程式為:2H2O 2H2↑+O2↑通電D.M與足量稀鹽酸反應生成的H2質量大于反應2產生的H2質量 發布:2024/12/31 8:0:1組卷:48引用:2難度:0.5 -
3.某種家用的消毒液的主要成分是次氯酸鈉(NaClO),制取NaClO的化學方程式為:Cl2+2NaOH=NaClO+NaCl+H2O,下列說法錯誤的是( )
A.NaClO中氯元素的化合價為-1 B.反應中用到的NaOH俗稱燒堿 C.該化學方程式中涉及到兩種鹽 D.反應前后氯元素化合價既升高又降低 發布:2025/1/3 8:0:1組卷:71引用:1難度:0.7


