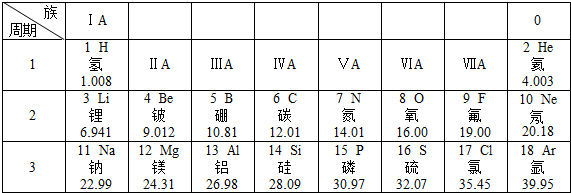
元素周期表是學習化學的重要工具。下面是元素周期表中1~18號元素原子核外電子排布,我們對它進行研究:
(1)第16號元素屬于非金屬非金屬元素(填“金屬”或“非金屬”),它在化學反應中容易得得(填“得”或“失”)電子;
(2)元素的化學性質與原子結構中的最外層電子最外層電子數關系密切;
(3)由原子序數為8和13的兩種元素組成的化合物是Al2O3Al2O3(寫化學式);
(4)在同一族中,各元素的原子結構呈現的規律有電子層數遞增(或最外層電子數相等或從上到下核電荷數增大等)電子層數遞增(或最外層電子數相等或從上到下核電荷數增大等)(任寫一點);
(5)研究表明:第二周期從3~9號元素的原子電子層數相同,核電荷數逐漸增大,核對核外電子的引力逐漸增大,故原子半徑逐漸減小。我分析第三周期從11~17號元素原子半徑變化規律是從左至右隨著核電荷數增加原子半徑反而逐漸減小從左至右隨著核電荷數增加原子半徑反而逐漸減小。
【考點】元素周期表結構及簡單規律;原子結構示意圖.
【答案】非金屬;得;最外層電子;Al2O3;電子層數遞增(或最外層電子數相等或從上到下核電荷數增大等);從左至右隨著核電荷數增加原子半徑反而逐漸減小
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:7引用:1難度:0.6
相似題
-
1.下表是元素周期表的部分內容,請認真分析并回答后面的問題:
(1)請從上表中查出地殼中含量最多的金屬元素的相對原子質量為.
(2)表中不同種元素最本質的區別是(填序號):
A.相對原子質量不同 B.質子數不同 C.中子數不同
(3)元素周期表中每一個橫行叫做一個周期,通過分析,同一周期元素之間的排列有一定的規律,如:(填字母序號)、…
A從左到右各元素原子的電子層數相同
B從左到右,各元素原子的原子序數依次增加
C從左到右,各元素原子的最外層電子數相同
(4)元素周期表中,原子序數為12的鎂元素的原子結構示意圖如圖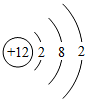 ,該原子在化學反應中易(“得到”“失去”)電子.說明元素的化學性質與原子的關系密切.
,該原子在化學反應中易(“得到”“失去”)電子.說明元素的化學性質與原子的關系密切.
(5)僅含碳和氫兩種元素的有機物稱為烴,如烷烴、烯烴、炔烴等.烷烴中最簡單的是甲烷(CH4),其余隨碳原子數的增加,依次為乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等.如果烷烴中的碳原子數為n,則烷烴的化學式可以用通式表示.它們在氧氣中完全燃燒的產物都是二氧化碳和水,試寫出甲烷在空氣中充分燃燒的化學方程式:.發布:2024/11/26 8:0:2組卷:13引用:1難度:0.3 -
2.如圖是元素周期表的一部分,根據圖表的信息回答下列問題.
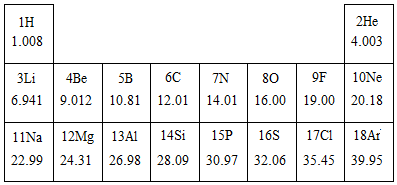
(1)13號元素的名稱為.
(2)相對原子質量為28.09的元素屬于元素(填“金屬”或“非金屬”).F的相對原子質量為.
(3)不同種元素的本質區別是(填字母序號).
A.質子數不同B.相對原子質量不同C.中子數不同
(4)如圖為R3+粒子結構示意圖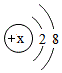 ,則X=,該元素位于周期表中第周期.
,則X=,該元素位于周期表中第周期.
(5)與鈉元素化學性質相似的元素是(填元素符號).發布:2025/1/18 8:0:1組卷:41引用:1難度:0.7 -
3.圖1是元素周期表的一部分,據此回答下列問題.
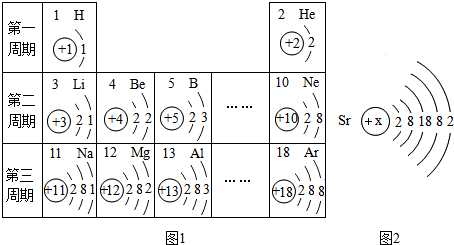
(1)表中13號元素是鋁元素,該元素的原子在化學反應中易(填“得到”或“失去”)電子,形成離子,其離子符號是.
(2)通過上表分析可得出的規律有(寫一點).
(3)圖2是Sr元素的原子結構示意圖,則x=,該元素屬于元素(填“金屬”、“非金屬”或“稀有氣體”),其化學性質與上表中的(填符號)元素相似,通過圖1分析可知,該元素位于元素周期表第周期.發布:2024/12/9 8:0:2組卷:1引用:1難度:0.5


