 (1)比較酸性溶液中的氧化性強(qiáng)弱:MnO2>>Fe3+(填“>”、“<”或“=”);用一個離子方程式說明MnO2與Fe3+氧化性的相對強(qiáng)弱 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2OMnO2+4H++2Fe2+=Mn2++2Fe3++2H2O。
(1)比較酸性溶液中的氧化性強(qiáng)弱:MnO2>>Fe3+(填“>”、“<”或“=”);用一個離子方程式說明MnO2與Fe3+氧化性的相對強(qiáng)弱 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2OMnO2+4H++2Fe2+=Mn2++2Fe3++2H2O。
(2)氰酸銨(NH4CNO)是一種銨鹽,除氫原子外,各原子均滿足8電子穩(wěn)定結(jié)構(gòu),請寫出氰酸銨的電子式 
 。
。
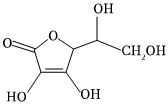
(3)抗壞血酸(結(jié)構(gòu)簡式如圖所示)易溶于水的主要原因 抗壞血酸分子中含有4個—OH,與溶劑水形成分子間氫鍵,因此易溶于水抗壞血酸分子中含有4個—OH,與溶劑水形成分子間氫鍵,因此易溶于水。


【答案】>;MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O; ;抗壞血酸分子中含有4個—OH,與溶劑水形成分子間氫鍵,因此易溶于水
;抗壞血酸分子中含有4個—OH,與溶劑水形成分子間氫鍵,因此易溶于水
 ;抗壞血酸分子中含有4個—OH,與溶劑水形成分子間氫鍵,因此易溶于水
;抗壞血酸分子中含有4個—OH,與溶劑水形成分子間氫鍵,因此易溶于水【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:45引用:3難度:0.5
相似題
-
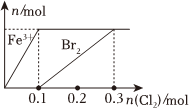 1.向200mLFeBr2溶液中逐漸通入Cl2,其中n(Fe3+)、n(Br2 )隨通入n(Cl2)的變化如圖所示,下列說法錯誤的是( )
1.向200mLFeBr2溶液中逐漸通入Cl2,其中n(Fe3+)、n(Br2 )隨通入n(Cl2)的變化如圖所示,下列說法錯誤的是( )A.還原性強(qiáng)弱:Fe2+>Br- B.由圖可知,該FeBr2溶液的濃度為1mol?L-1 C.n(Cl2)=0.12mol時,溶液中的離子濃度有 ═c(Fe3+)c(Br-)59D.氯氣過量時,反應(yīng)的離子方程式為:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- 發(fā)布:2024/12/7 9:30:1組卷:50引用:3難度:0.5 -
2.根據(jù)反應(yīng)式:①2Fe3++2I-═2Fe2++I2,②Br2+2Fe2+═2Br-+2Fe3+,可判斷離子的還原性從強(qiáng)到弱的順序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br- 發(fā)布:2024/11/28 12:30:2組卷:346引用:8難度:0.8 -
3.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2。
則下列判斷正確的是( )A.氧化性:MnO4->Fe3+>Cl2>I2 B.還原性:Cl->I->Fe2+ C.Fe3+只有氧化性,F(xiàn)e2+只有還原性 D.由信息推測:Cl2+2I-═2Cl-+I2反應(yīng)可以進(jìn)行 發(fā)布:2024/12/11 14:0:2組卷:421引用:7難度:0.4
相關(guān)試卷


