氮(N)元素和硼(B)元素是組成地殼的重要組成元素,試回答下列問題:
(1)基態(tài)N原子中,能量最高的電子所占據(jù)的原子軌道的形狀為 啞鈴形啞鈴形。
(2)第二周期中,第一電離能介于B元素和N元素間的元素為Be、C和 OO(填元素符號)。
(3)經(jīng)測定發(fā)現(xiàn),N2O5固體由NO+2和NO-3兩種離子組成,該固體中N原子雜化類型為sp和 sp2sp2,與NO+2互為等電子體的微粒有 SCN-或CO2或CS2或N-3SCN-或CO2或CS2或N-3(寫出一種)。
(4)銨鹽大多不穩(wěn)定,在NH4F、NH4I中,較易分解的是 NH4FNH4F,原因是 F原子半徑比I原子小,H→F鍵比H→I鍵強(qiáng)(H→F更易形成),F(xiàn)-更易奪取NH+4中的H+F原子半徑比I原子小,H→F鍵比H→I鍵強(qiáng)(H→F更易形成),F(xiàn)-更易奪取NH+4中的H+。
(5)晶體硼有多種變體,但其基本結(jié)構(gòu)單元都是由硼原子組成的正二十面體(見圖Ⅰ),每個頂點(diǎn)為一個硼原子,每個三角形均為等邊三角形。則每一個此基本結(jié)構(gòu)單元由 1212個硼原子構(gòu)成;若該結(jié)構(gòu)單元中有2個原子為10B(其余為11B),那么該結(jié)構(gòu)單元有 33種不同類型。
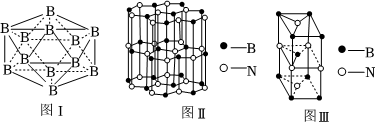
(6)硼和氮構(gòu)成的一種氮化硼晶體的結(jié)構(gòu)與石墨晶體結(jié)構(gòu)相類似,B、N原子相互交替排列(見圖Ⅱ),其晶胞結(jié)構(gòu)如圖Ⅲ所示。設(shè)層內(nèi)B-N核間距為apm,面間距為bpm,則該氮化硼晶體的密度為 2×(11+14)33a2bNA×10-302×(11+14)33a2bNA×10-30g/cm3(用含a、b、NA的代數(shù)式表示)。
NO
+
2
NO
-
3
NO
+
2
N
-
3
N
-
3
NH
+
4
NH
+
4
2
×
(
11
+
14
)
3
3
a
2
b
N
A
×
1
0
-
30
2
×
(
11
+
14
)
3
3
a
2
b
N
A
×
1
0
-
30
【考點(diǎn)】晶胞的計算;原子軌道雜化方式及雜化類型判斷.
【答案】啞鈴形;O;sp2;SCN-或CO2或CS2或;NH4F;F原子半徑比I原子小,H→F鍵比H→I鍵強(qiáng)(H→F更易形成),F(xiàn)-更易奪取中的H+;12;3;
N
-
3
NH
+
4
2
×
(
11
+
14
)
3
3
a
2
b
N
A
×
1
0
-
30
【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:21引用:1難度:0.6
相似題
-
 1.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序數(shù)依次增大,其相關(guān)信息如下:
1.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序數(shù)依次增大,其相關(guān)信息如下:
①A的周期序數(shù)等于其主族序數(shù);
②B、D原子的L層中都有兩個未成對電子;
③E元素原子最外層電子排布式為(n+1)Sn(n+1)Pn-1;
④F原子有四個能層,K、L、M全充滿,最外層只有一個電子.
試回答下列問題:
(1)基態(tài)E原子中,電子占據(jù)的最高能層符號為,F(xiàn)的價層電子排布式為.
(2)B、C、D的電負(fù)性由大到小的順序?yàn)?!--BA-->(用元素符號填寫),C與A形成的分子CA3的VSEPR模型為.
(3)B和D分別與A形成的化合物的穩(wěn)定性:BA4小于A2D,原因是.
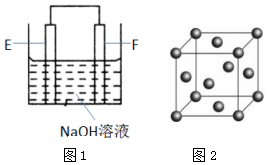
(4)以E、F的單質(zhì)為電極,組成如圖1所示的裝置,E極的電極反應(yīng)式為.
(5)向盛有F的硫酸鹽FSO4的試管里逐滴加入氨水,首先出現(xiàn)藍(lán)色沉淀,繼續(xù)滴加氨水,藍(lán)色沉淀溶解,得到深藍(lán)色溶液,再向深藍(lán)色透明溶液中加入乙醇,析出深藍(lán)色晶體.藍(lán)色沉淀溶解的離子方程式為.
(6)F的晶胞結(jié)構(gòu)(面心立方)如圖2所示:已知兩個最近的F的距離為acm,F的密度為g/cm3(阿伏加德羅常數(shù)用NA表示,F(xiàn)的相對原子質(zhì)量用M表示)發(fā)布:2025/1/18 8:0:1組卷:14引用:2難度:0.5 -
 2.鐵及其化合物在生產(chǎn)生活及科學(xué)研究方面應(yīng)用非常廣泛。
2.鐵及其化合物在生產(chǎn)生活及科學(xué)研究方面應(yīng)用非常廣泛。
(1)基態(tài)Fe原子的價層電子的電子排布圖為;其最外層電子的電子云形狀為。
(2)(NH4)2Fe(SO4)2?6H2O俗稱摩爾鹽
①NH4+電子式為。
②N、O兩元素的第一電離能由大到小的順序?yàn)?!--BA-->(用元素符號表示)
③SO42-中S原子的雜化方式為,VSEPR模型名稱為。
(3)K3[Fe(CN)6]晶體中中心原子的配位數(shù)為;晶體的配位體為(用化學(xué)符號表示)
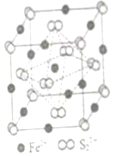
(4)FeS2晶體的晶胞如圖(c)所示。晶胞邊長為a nm、FeS2相對式量為M,阿伏加德羅常數(shù)的值為NA,其晶體密度的計算表達(dá)式為g?cm-3發(fā)布:2025/1/5 8:0:1組卷:7引用:1難度:0.7 -
 3.碳及其化合物有著重要用途。回答下列問題:
3.碳及其化合物有著重要用途。回答下列問題:
(1)基態(tài)碳原子的價層電子排布圖為。
(2)在CH2=CHCN中,碳原子的雜化方式有、,所含σ鍵數(shù)目和π鍵數(shù)目之比為。
(3)甲烷、水、氨氣中C、O、N原子均采用sp3雜化方式,VSEPR模型均為正四面體構(gòu)型,比較三者鍵角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室溫下為紫紅色固體,不溶于水,能溶于四氯化碳等非極性溶劑。據(jù)此判斷C60的晶體類型是。
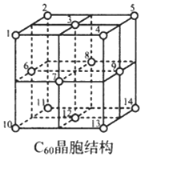
(5)C60晶胞結(jié)構(gòu)如圖,C60分子處于頂點(diǎn)和面心。已知:C60晶胞棱長為14.20? (1?=10-8cm),則C60的晶體密度為g/cm3。
C60體中存在正四面體空隙(例如1、3、6、7四點(diǎn)構(gòu)成)和正八面體空隙(例如3、6、7、8、9、12六點(diǎn)構(gòu)成),則平均每一個C60晶胞中有個正四面體空隙和4個正八面體空隙。當(dāng)堿金屬元素全部占滿所有空隙后,這類C60摻雜物才具有超導(dǎo)性。若用金屬銫(Cs)填滿所有空隙,距離最近的兩個Cs原子間的距離為?。發(fā)布:2025/1/5 8:0:1組卷:53引用:2難度:0.4
相關(guān)試卷


