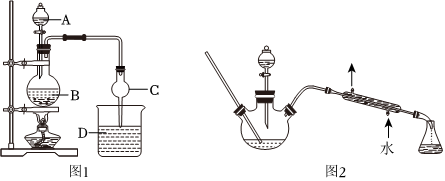
乙酸乙酯是食用香精中用量較大的合成香料之一,大量用于調配香蕉、梨、桃、菠蘿、葡萄等香型食用香精。某化學興趣小組設計的制備乙酸乙酯的裝置如圖1所示。
查閱資料知:
Ⅰ.CaCl2可與乙醇反應生成不溶于有機溶劑而溶于水的結晶醇化物。
Ⅱ.有關數據如表所示:
| 物質 | 乙醇 | 乙酸 | 乙酸乙酯 | 濃硫酸(98%) |
| 沸點/℃ | 78.5 | 117.9 | 77.0 | 338.0 |
①如圖所示,連接好裝置(裝置氣密性良好),在100mL圓底燒瓶內加入碎瓷片后,加入15mL乙醇,然后邊振蕩圓底燒杯邊慢慢加入10mL98%的濃硫酸,冷卻后,通過分液漏斗(A)向圓底燒瓶(B)內慢慢加入12mL乙酸、在燒杯D中加入飽和Na2CO3溶液。
②點燃酒精燈,用小火均勻加熱裝有混合溶液的圓底燒瓶。
③待D中收集到一定量產物后停止加熱,撤出C,將D中混合物攪拌,然后靜置分層。
④分離出乙酸乙酯層、洗滌、干燥。
請回答下列問題:
(1)碎瓷片的作用是
防止液體暴沸
防止液體暴沸
、濃硫酸的作用是 作催化劑和吸水劑
作催化劑和吸水劑
。若用同位素示蹤法來確定產物水分子中氧原子的提供者,請寫出能表示18O位置的制取乙酸乙酯的化學方程式:CH3CO18OH+CH3CH2OHCH3COOCH2CH3+O(或CH3COOH+CH3OHCH3CO18OCH2CH3+H2O)
濃硫酸
△
H
18
2
CH
18
2
濃硫酸
△
CH3CO18OH+CH3CH2OHCH3COOCH2CH3+O(或CH3COOH+CH3OHCH3CO18OCH2CH3+H2O)
。濃硫酸
△
H
18
2
CH
18
2
濃硫酸
△
(2)儀器C的名稱是
球形干燥管
球形干燥管
,其作用是加速乙酸乙酯冷凝和 防止倒吸
防止倒吸
。(3)D中飽和Na2CO3溶液的作用是
除去乙酸;溶解乙醇;降低乙酸乙酯的溶解度,有利于分層
除去乙酸;溶解乙醇;降低乙酸乙酯的溶解度,有利于分層
。(4)步驟②中需要小火均勻加熱的理由主要是
減少乙酸和乙醇的揮發,提高其轉化率,并防止副反應的發生
減少乙酸和乙醇的揮發,提高其轉化率,并防止副反應的發生
。(5)寫出步驟(3)中觀察到的現象:
溶液上層有油狀液體生成,有果香味
溶液上層有油狀液體生成,有果香味
。分離出乙酸乙酯層后,一般用飽和食鹽水和飽和氯化鈣溶液洗滌乙酸乙酯層,可除去 碳酸鈉、乙醇、乙酸鈉
碳酸鈉、乙醇、乙酸鈉
(填名稱)雜質。(6)該小組成員又設計了如圖2所示的制取乙酸乙酯的裝置(夾持裝置、加熱裝置圴已略去),與如圖1所示的裝置相比,本裝置的主要優點是
冷凝管的冷卻效果比空氣冷凝的效果好;能控制加熱的溫度,減少副反應的發生,提高產率(合理即可)
冷凝管的冷卻效果比空氣冷凝的效果好;能控制加熱的溫度,減少副反應的發生,提高產率(合理即可)
。【考點】乙酸乙酯的制取.
【答案】防止液體暴沸;作催化劑和吸水劑;CH3CO18OH+CH3CH2OHCH3COOCH2CH3+O(或CH3COOH+CH3OHCH3CO18OCH2CH3+H2O);球形干燥管;防止倒吸;除去乙酸;溶解乙醇;降低乙酸乙酯的溶解度,有利于分層;減少乙酸和乙醇的揮發,提高其轉化率,并防止副反應的發生;溶液上層有油狀液體生成,有果香味;碳酸鈉、乙醇、乙酸鈉;冷凝管的冷卻效果比空氣冷凝的效果好;能控制加熱的溫度,減少副反應的發生,提高產率(合理即可)
濃硫酸
△
H
18
2
CH
18
2
濃硫酸
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/1 8:0:9組卷:96引用:1難度:0.5
相似題
-
1.在酯化反應實驗中制得的乙酸乙酯中混有少量的乙酸,應選用下列哪種試劑洗滌除去( )
A.乙醇 B.飽和碳酸鈉溶液 C.水 D.NaOH溶液 發布:2024/12/30 8:30:1組卷:39引用:3難度:0.9 -
2.下面是甲、乙、丙三位同學制取乙酸乙酯的過程,請你參與并協助他們完成相關實驗任務.
【實驗目的】制取乙酸乙酯
【實驗原理】甲、乙、丙三位同學均采取乙醇、乙酸與濃硫酸混合共熱的方法制取乙酸乙酯.
【裝置設計】甲、乙、丙三位同學分別設計了下列三套實驗裝置:
請從甲、乙兩位同學設計的裝置中選擇一種作為實驗室制取乙酸乙酯的裝置,較合理的是(選填“甲”或“乙”).丙同學將甲裝置進行了改進,將其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是.
【實驗步驟】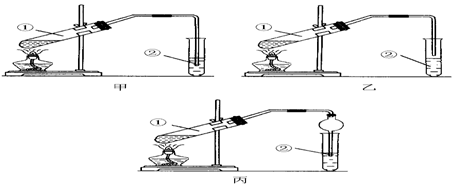
(1)按丙同學選擇的裝置組裝儀器,在試管中先加入3mL乙醇,并在搖動下緩緩加入2mL濃硫酸充分搖勻;冷卻后再加入2mL冰醋酸;
(2)將試管固定在鐵架臺上;
(3)在試管②中加入適量的飽和Na2CO3溶液;
(4)用酒精燈對試管①加熱;
(5)當觀察到試管②中有明顯現象時停止實驗.
【問題討論】
a.步驟(1)安裝好實驗裝置,加入樣品前還應檢查;
b.寫出試管①發生反應的化學方程式(注明反應條件);
c.試管②中飽和Na2CO3溶液的作用是;
d.從試管②中分離出乙酸乙酯的實驗操作是.發布:2024/12/30 19:30:2組卷:42引用:7難度:0.5 -
3.乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業。實驗室利用如圖A裝置制備乙酸乙酯。
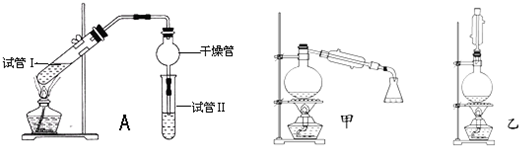
(1)若實驗中用乙酸和含18O的乙醇作用,該反應的化學方程式是:。與教材采用的實驗裝置不同,此裝置中采用了球形干燥管,其作用是。
(2)為了證明濃硫酸在該反應中起到了催化劑和吸水劑的作用,某同學利用上圖所示裝置進行了以下4個實驗。實驗開始先用酒精燈微熱3min,再加熱使之微微沸騰3min。實驗結束后充分振蕩小試管Ⅱ再測有機層的厚度,實驗記錄如下:
①實驗D的目的是與實驗C相對照,證明H+對酯化反應具有催化作用。實驗D中應加入鹽酸的體積和濃度分別是實驗編號 試管Ⅰ中試劑 試管Ⅱ中試劑 有機層的厚度/cm A 2mL乙醇、1mL乙酸、
1mL 18mol?L-1濃硫酸飽和Na2CO3溶液 3.0 B 2mL乙醇、1mL乙酸 0.1 C 2mL乙醇、1mL乙酸、
3mL 2mol?L-1H2SO40.6 D 2mL乙醇、1mL乙酸、鹽酸 0.6 mL和mol?L-1。
②分析實驗(填實驗編號)的數據,可以推測出濃H2SO4的吸水性提高了乙酸乙酯的產率。
(3)若現有乙酸90g,乙醇138g發生酯化反應得到88g乙酸乙酯,試計算該反應的產率為。
(4)現擬分離含乙酸、乙醇和水的乙酸乙酯粗產品,如圖是分離操作步驟流程圖。圖中內為適當的試劑,內為適當的分離方法。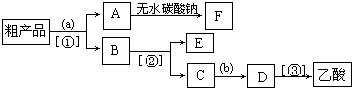
①試劑a是;分離方法②是,分離方法③是。分離方法①是分液,在具體操作中應充分振蕩,然后靜置,待分層后(填標號)。
A.直接將乙酸乙酯從分液漏斗上口倒出
B.直接將乙酸乙酯從分液漏斗下口放出
C.先將水層從分液漏斗的下口放出,再將乙酸乙酯從下口放出
D.先將水層從分液漏斗的下口放出,再將乙酸乙酯從上口放出
②在得到的A中加入無水碳酸鈉粉末,振蕩,目的是。
(5)為充分利用反應物,甲、乙兩位同學分別設計了如圖甲、乙兩個裝置(乙同學待反應完畢冷卻后,再用飽和碳酸鈉溶液提取燒瓶中的產物)。你認為最合理的是。發布:2024/12/30 19:0:1組卷:84引用:3難度:0.1


