利用下列裝置可以制取某些氣體,請回答下列問題。
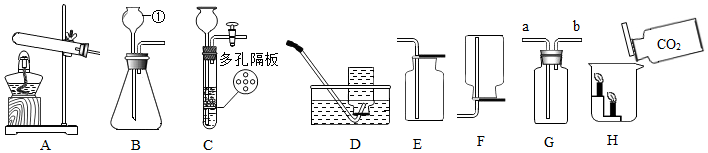
(1)實驗室用A裝置制取氧氣,反應的化學方程式為 2KClO3MnO2△2KCl+3O2↑或2KMnO4 △ K2MnO4+MnO2+O2↑2KClO3MnO2△2KCl+3O2↑或2KMnO4 △ K2MnO4+MnO2+O2↑。
(2)在A-F的裝置中,選擇實驗室制取二氧化碳的發生裝置和收集裝置的組合是 BE或CEBE或CE(填字母);與裝置B相比較,使用裝置C的優點為 可以控制反應的發生和停止可以控制反應的發生和停止。
(3)檢驗二氧化碳氣體時反應的化學方程式為 CO2+Ca(OH)2=CaCO3↓+H2OCO2+Ca(OH)2=CaCO3↓+H2O,若用裝置G收集二氧化碳,氣體應從 aa端進入,證明二氧化碳收集滿的方法是 將燃著的木條放在導管口b處,若木條熄滅,說明二氧化碳已滿將燃著的木條放在導管口b處,若木條熄滅,說明二氧化碳已滿。
(4)按圖中H裝置探究二氧化碳的性質,實驗現象說明CO2具有的化學性質是 不燃燒也不支持燃燒,密度比空氣大不燃燒也不支持燃燒,密度比空氣大。
(5)某化學興趣小組的同學在實驗室制二氧化碳后,欲測定一石灰石樣品中碳酸鈣的質量分數(假設樣品中雜質不溶于水也不與鹽酸反應)。將15.0克石灰石樣品放入燒杯中,再稱取100克且足量的稀鹽酸加入燒杯,充分反應后稱得燒杯中物質的總質量為110.6克,試求:
①生成二氧化碳的質量是 4.44.4克;
②該石灰石樣品中碳酸鈣的質量分數。(寫出計算過程,結果保留一位小數)
M
n
O
2
△
△
M
n
O
2
△
△
【答案】2KClO32KCl+3O2↑或2KMnO4 K2MnO4+MnO2+O2↑;BE或CE;可以控制反應的發生和停止;CO2+Ca(OH)2=CaCO3↓+H2O;a;將燃著的木條放在導管口b處,若木條熄滅,說明二氧化碳已滿;不燃燒也不支持燃燒,密度比空氣大;4.4
M
n
O
2
△
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:13引用:1難度:0.6
相似題
-
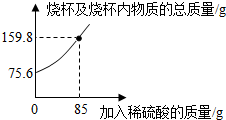 1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
(1)該實驗取用的樣品質量為g.
(2)計算樣品中鐵的質量分數(寫出解題過程).發布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
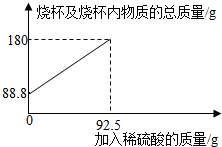 2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
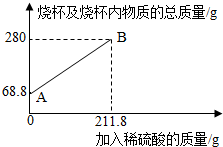 3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)求樣品中鐵的質量分數;反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


