某化學小組采用類似制乙酸乙酯的裝置(1如圖),用環己醇制環己烯。
已知: 濃硫酸85℃
濃硫酸85℃ +H2O
+H2O
濃硫酸
85
℃
| 密度(g.cm3 ) | 熔點℃ | 沸點℃ | 溶解性 | |
| 環己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.081 | -103 | 83 | 難溶于水 |

制備粗品:
將12.5mL環己醇加入試管A中,再加入lmL濃硫酸,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環己烯粗品。
(1)A中瓷片的作用是
防止暴沸
防止暴沸
,導管B除了導氣外還具有的作用是 冷凝
冷凝
;(2)試管C置于冰水浴中的目的是
進一步冷卻,防止環己烯揮發
進一步冷卻,防止環己烯揮發
。制備精品:
(3)環己烯粗品中含有環己醇和少量酸性雜質等。加入少量食鹽水,振蕩、靜置、分層,環己烯在
上
上
層(填“上”或“下”),分液后用 c
c
(填入編號)洗滌;a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
(4)再將環己烯按圖2裝置蒸餾,冷卻水從
g
g
(填f或g)口進入,蒸餾時要加入生石灰,目的是 除去了殘留的水
除去了殘留的水
。收集產品時,溫度應控制在 83℃
83℃
左右。(5)以下區分環己烯精品與粗品的方法,合理的是
bc
bc
。a.用酸性高錳酸鉀溶液
b.用金屬鈉
c.測定沸點
若用上述裝置制備乙酸乙酯,回答下列問題。
(6)用分液漏斗提純試管C中的乙酸乙酯,在操作時要注意振蕩洗滌后,靜置分液前必須放氣,具體操作方法是
c
c
(填編號)a.將儀器正放在架子或鐵圈上打開上部塞子
b.將儀器正放在架子或鐵圈上打開活塞
c.用手心抵住儀器上部塞子倒置后打開活塞
d.將該儀器平放在實驗臺上打開活塞
(7)所制得的酯應從該分液漏斗的
b
b
(填編號)a.下部流出
b.上口倒出
c.都可以
(8)在提純乙酸乙酯時,為什么要使用飽和碳酸鈉溶液,而不用NaOH溶液洗滌?
乙酸乙酯在氫氧化鈉溶液中會發生水解
乙酸乙酯在氫氧化鈉溶液中會發生水解
。【考點】乙酸乙酯的制取.
【答案】防止暴沸;冷凝;進一步冷卻,防止環己烯揮發;上;c;g;除去了殘留的水;83℃;bc;c;b;乙酸乙酯在氫氧化鈉溶液中會發生水解
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:18引用:1難度:0.6
相似題
-
1.在酯化反應實驗中制得的乙酸乙酯中混有少量的乙酸,應選用下列哪種試劑洗滌除去( )
A.乙醇 B.飽和碳酸鈉溶液 C.水 D.NaOH溶液 發布:2024/12/30 8:30:1組卷:39引用:3難度:0.9 -
2.下面是甲、乙、丙三位同學制取乙酸乙酯的過程,請你參與并協助他們完成相關實驗任務.
【實驗目的】制取乙酸乙酯
【實驗原理】甲、乙、丙三位同學均采取乙醇、乙酸與濃硫酸混合共熱的方法制取乙酸乙酯.
【裝置設計】甲、乙、丙三位同學分別設計了下列三套實驗裝置:
請從甲、乙兩位同學設計的裝置中選擇一種作為實驗室制取乙酸乙酯的裝置,較合理的是(選填“甲”或“乙”).丙同學將甲裝置進行了改進,將其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是.
【實驗步驟】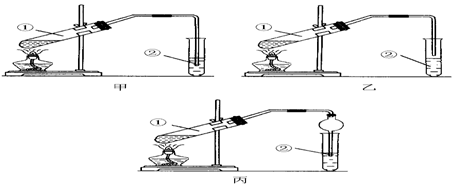
(1)按丙同學選擇的裝置組裝儀器,在試管中先加入3mL乙醇,并在搖動下緩緩加入2mL濃硫酸充分搖勻;冷卻后再加入2mL冰醋酸;
(2)將試管固定在鐵架臺上;
(3)在試管②中加入適量的飽和Na2CO3溶液;
(4)用酒精燈對試管①加熱;
(5)當觀察到試管②中有明顯現象時停止實驗.
【問題討論】
a.步驟(1)安裝好實驗裝置,加入樣品前還應檢查;
b.寫出試管①發生反應的化學方程式(注明反應條件);
c.試管②中飽和Na2CO3溶液的作用是;
d.從試管②中分離出乙酸乙酯的實驗操作是.發布:2024/12/30 19:30:2組卷:42引用:7難度:0.5 -
3.乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業。實驗室利用如圖A裝置制備乙酸乙酯。
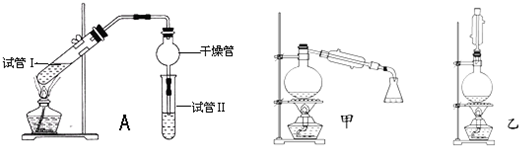
(1)若實驗中用乙酸和含18O的乙醇作用,該反應的化學方程式是:。與教材采用的實驗裝置不同,此裝置中采用了球形干燥管,其作用是。
(2)為了證明濃硫酸在該反應中起到了催化劑和吸水劑的作用,某同學利用上圖所示裝置進行了以下4個實驗。實驗開始先用酒精燈微熱3min,再加熱使之微微沸騰3min。實驗結束后充分振蕩小試管Ⅱ再測有機層的厚度,實驗記錄如下:
①實驗D的目的是與實驗C相對照,證明H+對酯化反應具有催化作用。實驗D中應加入鹽酸的體積和濃度分別是實驗編號 試管Ⅰ中試劑 試管Ⅱ中試劑 有機層的厚度/cm A 2mL乙醇、1mL乙酸、
1mL 18mol?L-1濃硫酸飽和Na2CO3溶液 3.0 B 2mL乙醇、1mL乙酸 0.1 C 2mL乙醇、1mL乙酸、
3mL 2mol?L-1H2SO40.6 D 2mL乙醇、1mL乙酸、鹽酸 0.6 mL和mol?L-1。
②分析實驗(填實驗編號)的數據,可以推測出濃H2SO4的吸水性提高了乙酸乙酯的產率。
(3)若現有乙酸90g,乙醇138g發生酯化反應得到88g乙酸乙酯,試計算該反應的產率為。
(4)現擬分離含乙酸、乙醇和水的乙酸乙酯粗產品,如圖是分離操作步驟流程圖。圖中內為適當的試劑,內為適當的分離方法。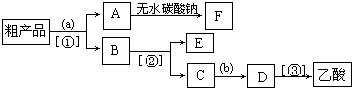
①試劑a是;分離方法②是,分離方法③是。分離方法①是分液,在具體操作中應充分振蕩,然后靜置,待分層后(填標號)。
A.直接將乙酸乙酯從分液漏斗上口倒出
B.直接將乙酸乙酯從分液漏斗下口放出
C.先將水層從分液漏斗的下口放出,再將乙酸乙酯從下口放出
D.先將水層從分液漏斗的下口放出,再將乙酸乙酯從上口放出
②在得到的A中加入無水碳酸鈉粉末,振蕩,目的是。
(5)為充分利用反應物,甲、乙兩位同學分別設計了如圖甲、乙兩個裝置(乙同學待反應完畢冷卻后,再用飽和碳酸鈉溶液提取燒瓶中的產物)。你認為最合理的是。發布:2024/12/30 19:0:1組卷:84引用:3難度:0.1


