當(dāng)前位置:
試題詳情
海洋是人類千萬年來賴以生存的重要資源寶庫,下圖是海水中化學(xué)資源的圖示.請(qǐng)結(jié)合圖示回答相關(guān)問題.
(1)取海水滴加AgNO3溶液的現(xiàn)象是產(chǎn)生白色沉淀產(chǎn)生白色沉淀.
(2)下列有關(guān)海水及其開發(fā)的說法正確的是adad.
a.圖1中海水所含化學(xué)資源都是化合物
b.蒸餾法淡化海水是化學(xué)變化
c.海水資源的開發(fā)不需要考慮環(huán)境保護(hù)問題
d.海水中含有NaCl和MgCl2
(3)海水中含有10個(gè)電子的微粒有H2O、Mg2+和Na+Na+.
(4)工業(yè)利用海水制取純堿和輕質(zhì)MgO的流程圖如圖3,據(jù)圖回答下列問題.
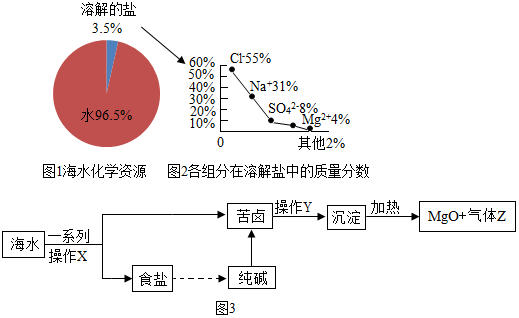
①M(fèi)gO的名稱是氧化鎂氧化鎂.
②海水曬鹽的一系列操作X是蒸發(fā)、降溫結(jié)晶降溫結(jié)晶、過濾;實(shí)驗(yàn)室進(jìn)行操作Y時(shí)需使用玻璃棒,其作用是引流引流.③氨堿法制取純堿是先制成飽和氨鹽水,再不斷通入二氧化碳,反應(yīng)生成碳酸氫鈉和氯化銨,產(chǎn)生析出碳酸氫鈉的原因是相同條件下,碳酸氫鈉的溶解度小于氯化銨的溶解度相同條件下,碳酸氫鈉的溶解度小于氯化銨的溶解度,碳酸氫鈉分解生成純堿的化學(xué)方程式是2NaHCO3 △ Na2CO3+H2O+CO2↑2NaHCO3 △ Na2CO3+H2O+CO2↑.
④苦鹵(含MgCl2與NaCl)加入純堿的反應(yīng)類型是復(fù)分解反應(yīng)復(fù)分解反應(yīng).
△
△
【考點(diǎn)】對(duì)海洋資源的合理開發(fā)與利用;鹽的化學(xué)性質(zhì);海水曬鹽的原理和過程;反應(yīng)類型的判定;書寫化學(xué)方程式、文字表達(dá)式、電離方程式.
【答案】產(chǎn)生白色沉淀;ad;Na+;氧化鎂;降溫結(jié)晶;引流;相同條件下,碳酸氫鈉的溶解度小于氯化銨的溶解度;2NaHCO3 Na2CO3+H2O+CO2↑;復(fù)分解反應(yīng)
△
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/11/3 8:0:2組卷:11引用:3難度:0.3
相似題
-
1.閩東的淡水和海水資源豐富
(1)興趣小組測(cè)量集中水樣的pH,得到下表數(shù)據(jù),其中堿性最強(qiáng)的是(填序號(hào))
(2)山泉水含有較多鈣、鎂離子,硬度較高水樣 來源 pH A 泉水:“海上仙都”-太姥山 6.8~7.0 B 河水:“海國桃園”-楊家溪 7.2~7.6 C 海水:“天然良港”-三都澳 7.8~8.0
①寫出鈣離子的符號(hào)
②若要降低其硬度,可采用的方法是(寫一種)
(3)海水是重要資源,處理的大致流程如圖: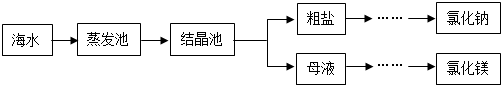
①粗鹽經(jīng)過溶解、過濾、蒸發(fā)可除去海沙等不溶性雜質(zhì).
a.海沙的主要成分是二氧化硅(SiO2),其中Si的化合價(jià)為.
b.若以上操作在實(shí)驗(yàn)室中進(jìn)行,溶解時(shí),玻璃棒的作用是.
②母液經(jīng)過處理,可得氯化鎂,點(diǎn)解熔融氯化鎂生成鎂和氯氣(Cl2).寫出電解氯化鎂的化學(xué)方程式:.發(fā)布:2024/12/22 8:0:1組卷:13引用:1難度:0.5 -
2.我國的領(lǐng)海主權(quán)不容侵犯,南海是我國的固有領(lǐng)海,蘊(yùn)藏著豐富的海洋資源。
(1)南海不僅蘊(yùn)含著大量的煤、石油、天然氣等常規(guī)能源,還蘊(yùn)藏著大量的可燃冰。可燃冰(主要成分是CH4)被科學(xué)家譽(yù)為“未來能源”,CH4燃燒的化學(xué)方程式,可燃冰作為能源與煤、石油相比的優(yōu)點(diǎn)是。
(2)南海某島采用風(fēng)力發(fā)電提供的電能對(duì)海水進(jìn)行了如圖1所示的綜合利用。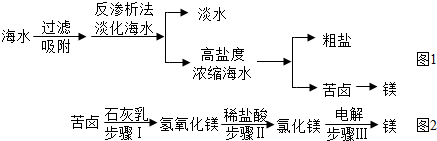
①反滲析法淡化海水是利用海水中各成分的不同分離出淡水。
②將高鹽度濃縮海水進(jìn)行可以分離得到粗鹽。
③用苦鹵制取金屬鎂的流程圖如圖2:
上述轉(zhuǎn)化過程中,所發(fā)生的反應(yīng)屬于復(fù)分解反應(yīng)類型的步驟是(填序號(hào)),步驟Ⅱ的化學(xué)方程式為。利用苦鹵制取氫氧化鎂比“直接向海水中加入石灰乳制取氫氧化鎂”的優(yōu)勢(shì)是。
(3)如圖3是海水“制堿”的部分簡單流程。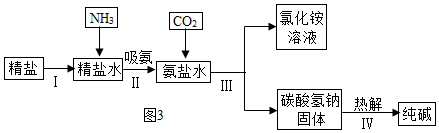
①步驟IⅡ反應(yīng)的化學(xué)方程式為;
②制氨鹽水的過程中要先通入氨氣,再通入二氧化碳,如果反過來,二氧化碳的吸收率會(huì)降低,這是因?yàn)?!--BA-->;
③氨鹽水吸收二氧化碳后生成碳酸氫鈉和氯化銨,首先析出的物質(zhì)是,原因是,將氯化銨溶液和碳酸氫鈉固體分離的方法是過濾,濾液中的溶質(zhì)有。發(fā)布:2024/12/25 12:0:1組卷:85引用:4難度:0.6 -
3.海洋是人類巨大的資源寶庫,其中含有的可溶性物質(zhì)包括MgCl2等。如圖為從海水中提取金屬鎂的簡易流程圖。

(1)海洋中含量最多的物質(zhì)是。
(2)貝殼煅燒的化學(xué)方程式是。
(3)操作Ⅰ的名稱是,進(jìn)行該操作時(shí),用到的玻璃儀器有燒杯、玻璃棒和。其中玻璃棒的作用是。
(4)生石灰轉(zhuǎn)化為石灰乳的過程是反應(yīng)(選填“吸熱”或“放熱”)。
(5)寫出氫氧化鎂和鹽酸反應(yīng)的化學(xué)方程式。
(6)上述流程中未涉及到的基本反應(yīng)類型是反應(yīng)。發(fā)布:2024/12/24 12:0:2組卷:221引用:4難度:0.2


