物質(zhì)結(jié)構(gòu)決定物質(zhì)的性質(zhì)。請依據(jù)物質(zhì)結(jié)構(gòu)理論,回答下列問題:
(1)MgO晶格能可通過圖1所示的bom-Haber循環(huán)計算得到。

Mg的第二電離能為14511451kJ?mol-1,O=O鍵的鍵能為498498kJ?mol-1,MgO的晶格能為38453845
kJ?mol-1
(2)磷化硼晶體晶胞如圖2所示:晶胞中磷原子空間堆積方式為面心立方最密堆積面心立方最密堆積,磷原子的配位數(shù)為44,
該結(jié)構(gòu)中存在配位鍵,提供空軌道的原子是BB。
(3)已知元素G原子核內(nèi)中子數(shù)比質(zhì)子數(shù)多21.一定條件下由G的雙原子分子組成的固體單質(zhì)密度為
5.06g?cm-3,在1×10-21cm3固體中含12個G2分子。則G的質(zhì)子數(shù)為5353,其核外電子排布式可
簡寫為[Kr]4d105s25p5[Kr]4d105s25p5。G2在不同溶劑中呈紫色或棕色,一般認為溶液呈棕色表明溶解了的G2和溶劑
發(fā)生強烈的結(jié)合;G2在石蠟油中的溶液因溫度不同呈紫色或棕色。則溫度高時溶液呈紫紫色,其原
因是溫度高時分子間作用力減弱,碘與溶劑未發(fā)生強烈結(jié)合溫度高時分子間作用力減弱,碘與溶劑未發(fā)生強烈結(jié)合。
【答案】1451;498;3845;面心立方最密堆積;4;B;53;[Kr]4d105s25p5;紫;溫度高時分子間作用力減弱,碘與溶劑未發(fā)生強烈結(jié)合
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:6引用:1難度:0.9
相似題
-
1.已知:
則乙苯催化脫氫制苯乙烯:化學鍵 C-H C-C C=C H-H 鍵能/kJ?mol ̄1 412 348 612 436  的反應熱為( )
的反應熱為( )A.+124 kJ/mol B.+246 kJ/mol C.+368 kJ/mol D.+429 kJ/mol 發(fā)布:2024/12/30 18:0:1組卷:19引用:2難度:0.9 -
2.德國化學家哈伯(F.Haber)從1902年開始研究由氮氣和氫氣直接合成氨。工業(yè)合成氨為解決世界的糧食問題做出了重要貢獻,其原理為N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1。若已知H-H鍵的鍵能為436.0kJ?mol-1,N-H的鍵能為390.8kJ?mol-1,則N≡N的鍵能約為
kJ?mol-1。發(fā)布:2024/12/30 19:0:1組卷:0引用:3難度:0.7 -
3.氫氣是一種清潔能源,也是一種重要的工業(yè)原料.
(1)氫氣既能與氮氣又能與氧氣發(fā)生反應,但是反應的條件卻不相同.
已知:2H2(g)+O2(g)=2H2O (g)ΔH=-483.6kJ/mol
3H2 (g)+N2(g)?2NH3(g)ΔH=-92.4kJ/mol
計算斷裂1mol N≡N鍵需要能量kJ,氮氣分子中化學鍵比氧氣分子中的化學鍵鍵(填“強”或“弱”),因此氫氣與二者反應的條件不同.
(2)氫氣是工業(yè)合成氨的原料氣,而氨氣可用于合成硝酸.已知:N2(g)+O2(g)=2NO (g)ΔH=+180.8kJ/mol,寫出氨氣與氧氣反應生成一氧化氮和氣態(tài)水的熱化學方程式.
(3)據(jù)報道,科學家在實驗室已研制出在燃料電池的反應容器中,利用特殊電極材料以H2
和O2為原料制取過氧化氫的新工藝.原理如圖2所示.請寫出甲電極的電極反應式.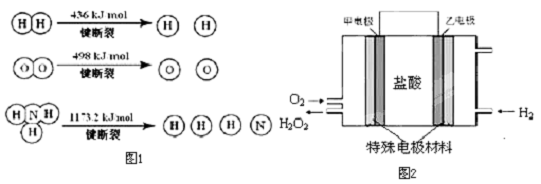 發(fā)布:2024/12/30 14:30:1組卷:9引用:3難度:0.1
發(fā)布:2024/12/30 14:30:1組卷:9引用:3難度:0.1
相關(guān)試卷


