某化學興趣小組采用如圖所示裝置研究NaHCO3分解的CO2與Na2O2反應。
完成下列填空:
(1)畫出乙中實驗裝置圖,并標出相應試劑
 。
。
(2)裝置丙中儀器名稱是 球形干燥管球形干燥管,其中反應的化學方程式是 2Na2O2+2CO2=2Na2CO3+O22Na2O2+2CO2=2Na2CO3+O2,該反應中氧化劑與還原劑的質(zhì)量比為 1:11:1。
(3)裝置丁中NaOH溶液的作用是 除去O2中的CO2除去O2中的CO2,裝置戊中澄清石灰水的作用是 檢驗O2中是否有CO2檢驗O2中是否有CO2。
(4)NaHCO3俗稱小蘇打,工業(yè)上可由通過侯氏制堿法制取(又稱聯(lián)合制堿法,由我國近代著名的化工學家侯德榜發(fā)明)。
①寫出侯氏制堿法中生成NaHCO3的離子方程式 Na++CO2+NH3+H2O→NaHCO3↓+NH4+Na++CO2+NH3+H2O→NaHCO3↓+NH4+。操作時,往飽和食鹽水中先通入 氨氣氨氣氣體,原因是 氨氣溶解性大而且溶液呈堿性后能吸收更多二氧化碳,增大HCO3-濃度,有利于碳酸氫鈉析出氨氣溶解性大而且溶液呈堿性后能吸收更多二氧化碳,增大HCO3-濃度,有利于碳酸氫鈉析出。
②在密閉容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反應。若殘留固體為純凈物,則起始時n(NaHCO3)n(Na2O2)應滿足的條件是 ≥2≥2。


n
(
N
a
HC
O
3
)
n
(
N
a
2
O
2
)
【考點】探究碳酸鈉與碳酸氫鈉的性質(zhì).
【答案】 ;球形干燥管;2Na2O2+2CO2=2Na2CO3+O2;1:1;除去O2中的CO2;檢驗O2中是否有CO2;Na++CO2+NH3+H2O→NaHCO3↓+NH4+;氨氣;氨氣溶解性大而且溶液呈堿性后能吸收更多二氧化碳,增大HCO3-濃度,有利于碳酸氫鈉析出;≥2
;球形干燥管;2Na2O2+2CO2=2Na2CO3+O2;1:1;除去O2中的CO2;檢驗O2中是否有CO2;Na++CO2+NH3+H2O→NaHCO3↓+NH4+;氨氣;氨氣溶解性大而且溶液呈堿性后能吸收更多二氧化碳,增大HCO3-濃度,有利于碳酸氫鈉析出;≥2
 ;球形干燥管;2Na2O2+2CO2=2Na2CO3+O2;1:1;除去O2中的CO2;檢驗O2中是否有CO2;Na++CO2+NH3+H2O→NaHCO3↓+NH4+;氨氣;氨氣溶解性大而且溶液呈堿性后能吸收更多二氧化碳,增大HCO3-濃度,有利于碳酸氫鈉析出;≥2
;球形干燥管;2Na2O2+2CO2=2Na2CO3+O2;1:1;除去O2中的CO2;檢驗O2中是否有CO2;Na++CO2+NH3+H2O→NaHCO3↓+NH4+;氨氣;氨氣溶解性大而且溶液呈堿性后能吸收更多二氧化碳,增大HCO3-濃度,有利于碳酸氫鈉析出;≥2【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:185引用:1難度:0.6
相似題
-
1.Ⅰ.某小組同學進行Na2CO3和NaHCO3性質(zhì)的探究,實驗如下(夾持裝置已略去,氣密性已檢驗)。
(1)實驗Ⅰ,能夠證明Na2CO3的熱穩(wěn)定性強于NaHCO3的證據(jù)是實驗Ⅰ 實驗Ⅱ 
 。
。
(2)實驗Ⅱ,方框中為洗氣裝置,請將該裝置補充完整。
(3)實驗Ⅱ,試劑a為。
(4)實驗Ⅱ,持續(xù)一段時間后,觀察到飽和Na2CO3溶液中有細小晶體析出,用化學方程式表示產(chǎn)生細小晶體的原因:。
Ⅱ.實驗小組繼續(xù)利用傳感器探究Na2CO3和NaHCO3的性質(zhì)。
【查閱資料】pH越小,c(OH-)越小,溶液堿性越弱。
【實驗過程】
【分析與解釋】編號 實驗操作 實驗數(shù)據(jù) 實驗Ⅰ 測量下述實驗過程的溫度變化 

實驗Ⅱ 測量下述實驗過程的pH變化 

(1)實驗Ⅰ中,溶解時吸收熱量的物質(zhì)是。
(2)實驗Ⅱ中,Na2CO3溶液和澄清石灰水反應的離子方程式為,OH-未參與該反應的實驗證據(jù)是。
(3)實驗Ⅱ中,滴加NaHCO3溶液的pH變化與滴加Na2CO3溶液的有明顯差異,原因是滴加NaHCO3溶液的燒杯中,參與反應的離子有。發(fā)布:2024/10/16 0:0:1組卷:20引用:1難度:0.7 -
2.某小組同學依據(jù)性質(zhì)差異,采用比較的方法設計實驗鑒別Na2CO3和NaHCO3。
(1)實驗Ⅰ中,分別向兩支試管中滴加幾滴水,A中溫度計示數(shù)略有降低,B中溫度計示數(shù)升高。說明固體b與水作用的過程中實驗Ⅰ 實驗Ⅱ 實驗Ⅲ 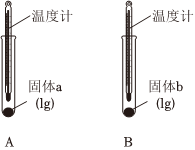
 (填“放出”或“吸收”)熱量,可判斷固體b為Na2CO3。
(填“放出”或“吸收”)熱量,可判斷固體b為Na2CO3。
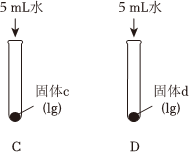
(2)實驗Ⅱ中,向試管C和D中分別加入5mL水,充分振蕩,試管C中固體有剩余,試管D中固體完全溶解。
①判斷固體d為。
②分別向兩支試管中滴加2滴酚酞,試管中紅色較淺。
(3)實驗Ⅲ中,分別向溶液e和溶液f中逐滴加入稀鹽酸,F(xiàn)中開始滴加就可以觀察到氣泡;E中開始無氣泡產(chǎn)生,一段時間后產(chǎn)生氣泡。結(jié)合離子方程式解釋E中開始無氣泡產(chǎn)生的原因。
(4)請你再設計一個鑒別Na2CO3和NaHCO3的實驗方案:。發(fā)布:2024/11/16 9:30:1組卷:92引用:2難度:0.7 -
3.國際化學年的中國宣傳口號是“化學——我們的生活,我們的未來”。學習化學應該明白“從生活中來,到生活中去”道理。請?zhí)羁眨?br />(1)①若金屬鈉等活潑金屬著火時,應該用
來滅火。
②小蘇打可治療胃酸過多,其反應的離子反應方程式為:。
(2)火藥是中國的“四大發(fā)明”之一。黑火藥在發(fā)生爆炸時,發(fā)生如下反應:2KNO3+3C+S═K2S+N2↑+3CO2↑其中被氧化的元素是,還原產(chǎn)物是。
(3)人體內(nèi)鐵元素是以Fe2+和Fe3+的形式存在。Fe2+易被人體吸收,服用維生素C,可使Fe3+轉(zhuǎn)化成Fe2+,有利于人體吸收,說明維生素C具有(填“氧化性”或“還原性”)。
(4)探究碳酸氫鈉的熱穩(wěn)定性,并利用其產(chǎn)物驗證過氧化鈉與二氧化碳的反應,按如圖裝置圖進行實驗。
①C中反應的化學方程式為。
②E中收集的氣體主要是。
(5)請將5種物質(zhì):N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分別填入下面對應的橫線上,組成一個已配平的化學方程式。
???+???→???+???+???+?H2O發(fā)布:2024/10/12 11:0:2組卷:48引用:1難度:0.7


