欲測定鹽酸與氯化鈣的混合溶液中氯化鈣的質量分數,進行了如下實驗:取混合溶液100g于錐形瓶中,向其中逐漸加入一定溶質質量分數的碳酸鈉溶液(如圖一),并不斷測定錐形瓶中溶液的pH.反應過程中所得溶液的pH與錐形瓶中物質的總質量的關系如圖二所示。其中,當錐形瓶中溶液的質量增加至147.8g時,共消耗碳酸鈉溶液的質量為50g。(忽略二氧化碳在水中溶解的量;氯化鈣溶液顯中性。)

(1)m點的數值是77。
(2)a→b段表示碳酸鈉與混合溶液中的鹽酸鹽酸反應。
(3)參加反應的碳酸鈉溶液的溶質的質量分數是10.6%10.6%。
(4)請計算原混合溶液中CaCl2的質量分數(寫計算過程)。
【答案】7;鹽酸;10.6%
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:30引用:3難度:0.5
相似題
-
1.學校為了防控新冠疫情,每天都要用消毒液對教室及公共區域進行消毒。二氧化氯消毒液是國際上公認的新一代強力、廣譜、安全、高效的消毒劑。二氧化氯消毒液能夠迅速、徹底殺滅各種細菌(大腸桿菌、白色念珠菌等)和病毒(肝炎病毒、流感病毒等)。小科觀察到瓶上的標簽如表所示。
求:二氧化氯(ClO2)1000毫升 溶質質量分數 80% 密度 1.2克/厘米3 強腐蝕性,陰冷,密封儲藏
(1)這1000毫升二氧化氯消毒液的質量是g,其中含溶質二氧化氯g。
(2)欲用該濃度的二氧化氯消毒液來配制30kg質量分數為20%的稀二氧化氯消毒液用來消毒,需要加水多少千克?發布:2024/12/28 16:30:2組卷:82引用:2難度:0.5 -
2.下表是20℃時,硝酸鉀溶解于水中的部分實驗數據,請回答下列問題:
(1)表中m=序號 水的質量(g) 加入硝酸鉀的質量 溶液質量 ① 20 3 23 ② 20 5 25 ③ 20 7 26.3 ④ 20 9 m 。
(2)20℃時,飽和硝酸鉀溶液溶質的質量分數是多少?
(3)20℃時,把100克溶質質量分數為20%的硝酸鉀溶液稀釋成5%的硝酸鉀溶液,需加水多少毫升?發布:2024/12/28 16:0:2組卷:16引用:2難度:0.5 -
3.食鹽是我們烹飪美食時的必需品之一,它的主要成分是氯化鈉。食鹽是一種白色的固體粉末,可溶于水,味道咸。食鹽又叫做鹽巴。古時候,如果人們想要得到食鹽,就必須通過海水來提煉;在現代社會中,人們通過高科技手段就能得到更細膩的食鹽,或者更多種類的食鹽。鹽場中經過長時間日曬往往會長出形狀各異的“鹽花”(主要成分為食鹽)。鹽花屬于粗鹽,如圖是粗鹽提純的部分實驗操作。
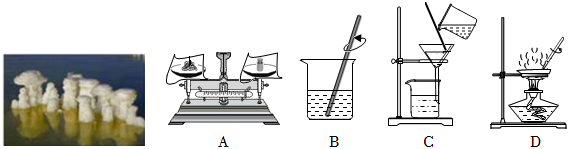
(1)一定質量粗鹽提純實驗的正確操作順序為。(填字母)
(2)鹽池中食鹽的質量分數始終保持在25%左右不再升高,試分析原因。
(3)提純的精鹽可用于一定質量分數食鹽溶液的配制。現需要配制質量分數為10%的食鹽溶液100克,理論上需要25%的鹽池溶液多少克?(寫出計算過程)發布:2024/12/28 14:30:1組卷:6引用:2難度:0.5


