 硫鐵礦(主要成分FeS2)是接觸法制硫酸的主要原料,接觸法制硫酸的生產原理分三步。
硫鐵礦(主要成分FeS2)是接觸法制硫酸的主要原料,接觸法制硫酸的生產原理分三步。
Ⅰ.4FeS2+11O2 △ 2Fe2O3+8SO2;
Ⅱ.2SO2+O2催化劑△2SO3;
Ⅲ.SO3+H2O=H2SO4
回答下列問題:
(1)①Fe2+形成的配合物亞鐵氰化鉀(K4[Fe(CN)6])又稱黃血鹽,可用于檢驗Fe3+。與CN-互為等電子體的陰離子為 C2-2C2-2(填離子符號,任寫一種)。
②氧原子價電子層上的電子可以進行重排以便提供一個空軌道與氮原子形成配位鍵,該氧原子重排后的價電子排布圖為 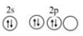
 ,電子重排后的氧原子能量有所升高,原因是不符合 洪特規(guī)則洪特規(guī)則(填“泡利原理”或“洪特規(guī)則”)。
,電子重排后的氧原子能量有所升高,原因是不符合 洪特規(guī)則洪特規(guī)則(填“泡利原理”或“洪特規(guī)則”)。
③已知Fe2+半徑為61pm,Co2+半徑為65pm,則在隔絕空氣條件下分別加熱FeCO3和CoCO3,FeCO3受熱分解溫度 低于低于(填“低于”或“高于”)CoCO3。
(2)過二硫酸的結構式為 ,S原子的雜化方式為 sp3sp3;S元素的化合價為 +6+6。
,S原子的雜化方式為 sp3sp3;S元素的化合價為 +6+6。
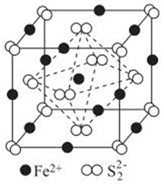
(3)FeS2晶體的晶胞結構如圖所示。
①FeS2晶體的晶胞中,Fe2+位于S22-所形成的 正八面體正八面體(填“正四面體”或“正八面體”,下同)空隙,S22-位于Fe2+所形成的正四面體正四面體空隙。該晶體中距離Fe2+最近的Fe2+的數目為 1212。
②FeS2晶體的晶胞參數為anm,密度為ρg?cm-3,阿伏加德羅常數的值為NA,則FeS2的摩爾質量M=ρ×NA×a3×10-214ρ×NA×a3×10-214g.jye.ai-1(用含a、ρ、NA的代數式表示)。
△
催化劑
△
2
-
2
2
-
2
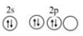
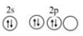
ρ
×
N
A
×
a
3
×
1
0
-
21
4
ρ
×
N
A
×
a
3
×
1
0
-
21
4
【答案】C;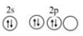 ;洪特規(guī)則;低于;sp3;+6;正八面體;正四面體;12;
;洪特規(guī)則;低于;sp3;+6;正八面體;正四面體;12;
2
-
2
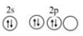 ;洪特規(guī)則;低于;sp3;+6;正八面體;正四面體;12;
;洪特規(guī)則;低于;sp3;+6;正八面體;正四面體;12;ρ
×
N
A
×
a
3
×
1
0
-
21
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網所有,未經書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:39引用:1難度:0.6
相似題
-
1.在液氨中投入金屬鈉,迅速溶劑化得到藍色電子液[Na+(NH3)x和e-(NH3)y]且過程中有少量H2產生。下列說法正確的是( )
A.液氨為電解質 B.電子通過配位鍵和NH3結合 C.e-(NH3)y和Na+(NH3)x示意圖為: 
D.鈉與液氨的反應可表示為:2Na+2NH3═2NaNH2+H2↑ 發(fā)布:2025/1/4 8:0:1組卷:22引用:3難度:0.6 -
2.ZnSO4溶于氨水形成[Zn(NH3)4]SO4,其中配離子[Zn(NH3)4]2+的立體構型為正四面體形。下列說法正確的是( )
A.[Zn(NH3)4]SO4里只含有共價鍵 B.[Zn(NH3)4]SO4中配體的VSEPR模型是四面體形 C.1mol[Zn(NH3)4]SO4固體中σ鍵的數目為16mol D.若用2個Cl-替換[Zn(NH3)4]2+中的2個NH3,可得到2種新的配離子 發(fā)布:2025/1/5 8:0:1組卷:58引用:1難度:0.5 -
3.Pt(NH3)2Cl2可以形成兩種固體,一種為淡黃色,在水中的溶解度小,另一種為黃綠色,在水中的溶解度較大,請回答下列問題:
(1)Pt(NH3 )2 Cl2是平面正方形結構,還是四面體結構.
(2)請畫出這兩種固體分子的幾何構型圖,淡黃色固體:. 黃綠色固體:.
(3)淡黃色固體物質是由分子組成,黃綠色固體物質是由分子組成(填“極性分子”或“非極性分子”)發(fā)布:2024/12/30 17:0:2組卷:75引用:3難度:0.1


