 銅的化合物在工農(nóng)業(yè)生產(chǎn)中具有重要地位。請按要求回答下列問題。
銅的化合物在工農(nóng)業(yè)生產(chǎn)中具有重要地位。請按要求回答下列問題。
Ⅰ.納米級Cu2O由于具有優(yōu)良的催化性能而受到關(guān)注,下表為制取Cu2O的三種方法:
| 方法a | 用葡萄糖還原新制的Cu(OH)2(NaOH過量)制備Cu2O |
| 方法b | 用肼(N2H4)加熱還原新制的Cu(OH)2制備Cu2O,同時放出N2 |
| 方法c | 用炭粉在1000℃以上還原CuO制備Cu2O,同時放出CO |
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOHCH2OH(CHOH)4COONa+Cu2O↓+3H2O
加熱
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOHCH2OH(CHOH)4COONa+Cu2O↓+3H2O
。加熱
(2)已知:
①2Cu(s)+
1
2
②C(s)+
1
2
③CuO(s)═Cu(s)+
1
2
寫出方法c反應(yīng)的熱化學方程式
C(s)+2CuO(s)Cu2O(s)+CO(g)ΔH=+34.5kJ?mol-1
1000
℃
以上
C(s)+2CuO(s)Cu2O(s)+CO(g)ΔH=+34.5kJ?mol-1
。1000
℃
以上
(3)在相同的密閉容器中,用上表方法制得的三種Cu2O分別進行催化分解水的實驗:2H2O(g)
光照
C
u
2
O
| 序號 | t/min c/mol?L-1 T/℃ |
0 | 10 | 20 | 30 | 40 | 50 |
| ⅰ | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ⅱ | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ⅲ | T2 | 0.100 | 0.0960 | 0.0930 | 0.0900 | 0.0900 | 0.0900 |
①催化劑的催化效率:實驗ⅰ
<
<
實驗ⅱ(填“>”、“<”“=”,下同)。②T1
<
<
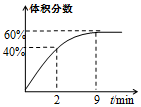
T2。Ⅱ.在2L的恒溫密閉容器中通入5mol O2并加入足量Cu2S發(fā)生反應(yīng):Cu2S(s)+O2(g)═2Cu(s)+SO2(g)ΔH1=-271.4kJ/mol,反應(yīng)過程中某氣體的體積分數(shù)隨時間變化如圖所示。
(4)反應(yīng)前2min平均反應(yīng)速率v(SO2)=
0.5 mol/(L?min)
0.5 mol/(L?min)
;該溫度下反應(yīng)的平衡常數(shù)K=1.5
1.5
。若保持溫度不變向平衡體系中再通入1mol O2,達到新平衡后氧氣的體積分數(shù)等于
等于
(填“大于”、“小于”或“等于”)原平衡時氧氣的體積分數(shù)。【答案】CH2OH(CHOH)4CHO+2Cu(OH)2+NaOHCH2OH(CHOH)4COONa+Cu2O↓+3H2O;C(s)+2CuO(s)Cu2O(s)+CO(g)ΔH=+34.5kJ?mol-1;<;<;0.5 mol/(L?min);1.5;等于
加熱
1000
℃
以上
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:59引用:2難度:0.5
相似題
-
1.把質(zhì)量為m g的銅絲灼燒變黑后,立即放入下列物質(zhì)中,銅絲變紅且質(zhì)量仍為m g的是( )
A.稀硝酸 B.醋酸溶液 C.乙醇 D.CH3CHO 發(fā)布:2024/12/30 19:30:2組卷:51引用:3難度:0.9 -
2.(1)H、B、N、Cl四種元素中不屬于p區(qū)的為
(填元素名稱),未成對電子數(shù)目最多的基態(tài)原子的電子排布式為,同周期第一電離能介于B和N之間的元素有種。
(2)最重要的含鈹?shù)V物是綠柱石,含2%鉻(Cr)的綠柱石即為祖母綠。基態(tài)Cr原子的價層電子軌道表示式為。
(3)鈹與相鄰主族的鋁元素性質(zhì)相似。下列有關(guān)鈹和鋁的敘述正確的有(填字母)。
A.都屬于p區(qū)主族元素
B.電負性都比鎂大
C.第一電離能都比鎂大
D.氯化物的水溶液pH均小于7
(4)Mn、Fe兩元素的部分電離能數(shù)據(jù)列于表:
比較Mn、Fe兩元素的I2、I3可知,氣態(tài)Mn2+再失去一個電子比氣態(tài)Fe2+再失去一個電子難。對此,你的解釋是元素 Mn Fe 電離能/(kJ?mol-1) I1 717 759 I2 1509 1561 I3 3248 2957 。
(5)高溫下CuO容易轉(zhuǎn)化為Cu2O的原因是。發(fā)布:2024/12/30 13:0:2組卷:5引用:3難度:0.5 -
3.某化學課外小組利用廢銅制取硫酸銅,設(shè)計了如下制取方案,其中從理論、操作、經(jīng)濟、環(huán)保等方面考慮,你認為最合理的是( )
A.Cu CuSO4稀硫酸△B.Cu CuSO4濃硫酸△C.Cu CuOO2△CuSO4稀硫酸D.Cu Cu(NO3)2AgNO3溶液Cu( OH)2NaOH溶液CuSO4稀硫酸發(fā)布:2024/12/30 14:30:1組卷:29引用:3難度:0.7
相關(guān)試卷


