化工專家侯德榜發明的侯氏制堿法為我國純堿工業和國民經濟發展做出了重要貢獻,某化學興趣小組在實驗室中模擬并改進侯氏制堿法制備NaHCO3,進一步處理得到產品Na2CO3和NH4Cl,并探究其相關性質,實驗流程如圖1。
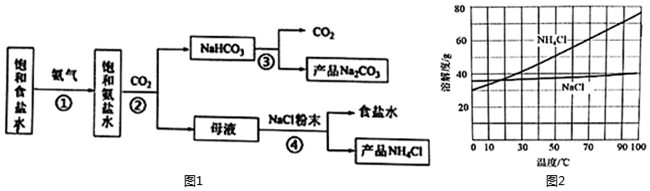
(1)寫出步驟②的化學方程式 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4ClNaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(2)流程中可以循環使用的物質是 二氧化碳二氧化碳、食鹽水食鹽水。
(3)向母液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)過程。為使NH4Cl沉淀充分析出并分離,根據NaCl和NH4Cl溶解度曲線(圖2),需采用的操作為 蒸發濃縮、冷卻結晶蒸發濃縮、冷卻結晶、過濾、洗滌、干燥。
(4)探究碳酸鈉和碳酸氫鈉的性質(已知:pH越小,c(OH-)越小,溶液堿性越弱。)
| 實驗操作 | 實驗現象 | |
| 實驗Ⅰ | 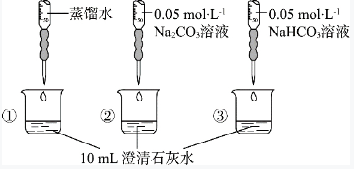 |
a.②③中均產生白色沉淀 b.溶液pH變化 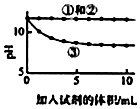 |
| 實驗Ⅱ |
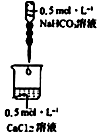
|
燒杯中產生白色沉淀 無色氣泡 |
空白對照
空白對照
,滴加NaHCO3溶液的燒杯中溶液pH的變化與滴加Na2CO3溶液的有明顯差異,原因是滴加NaHCO3溶液的燒杯中 HCO3-與OH-
HCO3-與OH-
不共存(填離子符號);②根據實驗Ⅱ的實驗現象,書寫相關離子方程式
Ca2++2HCO3-=CaCO3↓+CO2↑+H2O
Ca2++2HCO3-=CaCO3↓+CO2↑+H2O
。【考點】純堿工業(侯氏制堿法).
【答案】NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;二氧化碳;食鹽水;蒸發濃縮、冷卻結晶;空白對照;HCO3-與OH-;Ca2++2HCO3-=CaCO3↓+CO2↑+H2O
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:15引用:1難度:0.6
相似題
-
1.以NaCl為原料,可制取純堿。Na2CO3可用侯氏制堿法制取,主要涉及如下反應:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,下列有關實驗室模擬侯氏制堿法的實驗原理和裝置正確的是( )△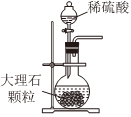
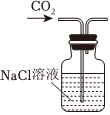
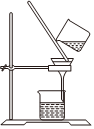
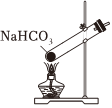
A.制取CO2 B.制取NaHCO3 C.分離NaHCO3 D.制取Na2CO3 A.A B.B C.C D.D 發布:2024/12/8 18:0:1組卷:165引用:5難度:0.8 -
2.“侯氏制堿法”的主要過程如圖(部分物質已略去)。
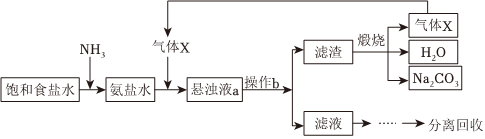
下列說法錯誤的是( )A.氣體X為CO2 B.操作b為過濾 C.懸濁液a中的不溶物主要是NH4Cl D.氨鹽水中通入氣體X后,溶液中Na+大量減少 發布:2024/12/8 0:0:1組卷:133引用:4難度:0.7 -
3.氨堿法(索氏)和聯合制堿法(侯氏)是兩大重要的工業制堿法,下列表達正確的是( )
氨堿法 聯合制堿法 A 原料 食鹽、氨氣、生石灰 食鹽、氨氣、二氧化碳 B 副產物 氯化鈣 氯化銨 C 循環物質 氨氣、二氧化碳 氯化鈉 D 評價 原料易得、設備簡單、能耗低 原料利用率高、廢棄物少 A.A B.B C.C D.D 發布:2024/12/16 6:0:1組卷:38引用:2難度:0.8


