在生活、生產中改良酸性土壤、中和廢水、治療胃酸過多等均是酸堿中和反應原理的具體體現。在實驗課上,發現有部分中和反應現象并不明顯。
【提出問題】以氫氧化鈉溶液與鹽酸為例,如何證明它們發生中和反應了呢?
【設計實驗】
方案一:甲同學利用酸堿指示劑的變色來證明兩者反應,選行了下列操作。
步驟一:取一定量的氫氧化鈉溶液于小燒杯中,滴加2~3滴無色酚酞試液;
步驟二:用膠頭滴管吸取稀鹽酸,逐滴滴入燒杯中,邊滴邊用玻璃棒攪拌。
(1)直至看到 溶液恰好由紅色變為無色溶液恰好由紅色變為無色現象時,甲同學認為兩者恰好完全反應了。
【實驗反思】
(2)乙同學取適量甲同學實驗后的溶液于試管中繼續探究,下列方法能說明兩者是否恰好完全反應的是 CC。(填字母)
A.再滴一滴稀鹽酸,溶液呈無色
B.再滴一滴稀鹽酸,溶液呈紅色
C.再滴一滴氫氧化鈉溶液,溶液呈無色
D.再滴一滴氫氧化鈉溶液,溶液呈紅色
方案二:有同學認為,可以通過檢驗是否有氯化鈉生成來證明氫氧化鈉溶液與鹽酸的反應,于是用玻璃棒蘸取甲同學實驗后的溶液放在酒精燈上蒸干,發現有白色固體析出,從而得出結論:氫氧化鈉溶液確實與鹽酸反應生成了氯化鈉。
【提出質疑】
(3)同學們立即表示反對,因為 白色固體也有可能是氫氧化鈉白色固體也有可能是氫氧化鈉。
(4)大家經過商量決定將白色固體溶解于少量水中,再檢驗白色固體成分,下列藥品可行的是 ACDACD(填字母)。
A.CuSO4溶液
B.稀鹽酸
C.酚酞溶液
D.FeCl3溶液
【拓展延伸】還有同學想到中和反應生成鹽和水,于是利用水的生成來說明酸和堿反應。
【查閱資料】Ⅰ.變色硅膠吸水后由藍色變為紅色。
Ⅱ.無水醋酸與氫氧化鈉反應生成醋酸鈉和水。
同學們經過討論設計了下列三個實驗:
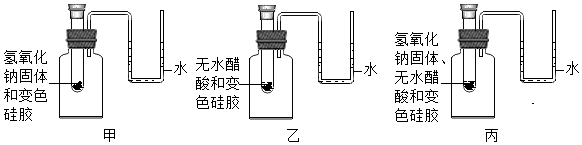
(5)證明無水醋酸與氫氧化鈉反應的現象是 甲乙中變色硅膠不變色,仍然為藍色,丙中變色硅膠由藍色變為紅色甲乙中變色硅膠不變色,仍然為藍色,丙中變色硅膠由藍色變為紅色。
(6)造成丙中U形管左側液面降低、右側液面升高的原因可能是:氫氧化鈉和無水醋酸發生中和反應,中和反應放熱氫氧化鈉和無水醋酸發生中和反應,中和反應放熱。
【反思總結】
在老師的指導下,同學們終于找到了證明中和反應發生的方法,主要通過兩條途徑:a、證明反應物減少了;b、證明新物質的生成。
(7)請你再寫出一個不屬于中和反應并且沒有明顯現象的反應:CO2+2NaOH=Na2CO3+H2OCO2+2NaOH=Na2CO3+H2O。(用化學方程式表示)
(8)綜上兩個中和反應,他們的微觀本質都是 氫離子與氫氧根離子結合成水分子氫離子與氫氧根離子結合成水分子。
【考點】中和反應及其應用.
【答案】溶液恰好由紅色變為無色;C;白色固體也有可能是氫氧化鈉;ACD;甲乙中變色硅膠不變色,仍然為藍色,丙中變色硅膠由藍色變為紅色;氫氧化鈉和無水醋酸發生中和反應,中和反應放熱;CO2+2NaOH=Na2CO3+H2O;氫離子與氫氧根離子結合成水分子
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:289引用:3難度:0.5
相似題
-
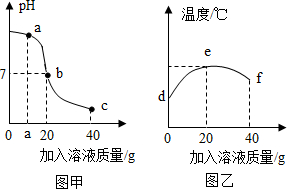 1.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )
1.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )A.當加入20g氫氧化鈉溶液時恰好完全反應 B.a點時溶液中的溶質為氫氧化鈉和氯化鈉 C.溫度上升是由于中和反應放熱,溫度下降是因為增加液體 D.e點時溶液中的溶質為氯化鈉 發布:2024/12/25 17:0:2組卷:71引用:3難度:0.6 -
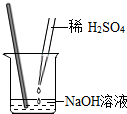 2.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )
2.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )A.無色 B.紅色 C.紫色 D.藍色 發布:2024/12/25 17:0:2組卷:68引用:3難度:0.9 -
3.某研究性學習小組為了探究氫氧化鈉溶液與稀硫酸是否恰好完全反應,分別取少量反應后的溶液于試管中,用下表中的不同試劑進行實驗.下列選項正確的是( )
選項 所用試劑 現象和結論 A 硫酸銅溶液 出現藍色沉淀,則氫氧化鈉過量 B 氯化鋇溶液 出現白色沉淀,則硫酸過量 C 銅絲 有氣泡產生,則硫酸過量 D 無色酚酞溶液 溶液不變色,則恰好完全反應 A.A B.B C.C D.D 發布:2024/12/25 17:30:2組卷:46引用:2難度:0.7


