海水曬制可得粗鹽,粗鹽除NaCl 外,還含有CaCl2、Na2SO4以及泥沙等雜質。現設計一種制備精鹽的實驗流程,步驟如圖。

①實驗流程中加入過量X、Y溶液中的溶質分別是IIIIII。
| 選項 溶質 |
Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| X | Na2CO3 | Na2CO3 | BaCl2 | Ba(NO3)2 |
| Y | BaCl2 | Ba(NO3)2 | Na2CO3 | Na2CO3 |
可以除去雜質Na2SO4、CaCl2,并除去了過量的BaCl2
可以除去雜質Na2SO4、CaCl2,并除去了過量的BaCl2
。②判斷Y溶液過量的方法是
III、IV
III、IV
。I.取少量溶液A滴入硝酸銀溶液,出現白色沉淀
Ⅱ.取少量沉淀滴入鹽酸,有氣泡產生
Ⅲ.取少量溶液A,滴入紫色石蕊,溶液變藍
Ⅳ.取少量溶液A滴入石灰水,出現白色沉淀
③沉淀中除了泥沙等難溶雜質,還主要有
BaCO3、BaSO4、CaCO3
BaCO3、BaSO4、CaCO3
物質。加入Z溶液過量,但對精鹽制備沒有影響不必除去,這是利用Z溶液的易揮發
易揮發
性質。【考點】氯化鈉與粗鹽提純.
【答案】III;可以除去雜質Na2SO4、CaCl2,并除去了過量的BaCl2;III、IV;BaCO3、BaSO4、CaCO3;易揮發
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:170引用:6難度:0.9
相似題
-
 1.去除難溶性雜質后的食鹽樣品中還含有可溶性雜質:CaCl2、MgCl2和Na2SO4.為除去可溶性雜質,將食鹽樣品溶于水,依次加入稍過量的三種溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反應后過濾,得濾渣X,向濾液中加入過量的稀鹽酸,攪拌、煮沸,得氯化鈉溶液。下列說法正確的是( )
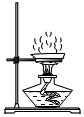
1.去除難溶性雜質后的食鹽樣品中還含有可溶性雜質:CaCl2、MgCl2和Na2SO4.為除去可溶性雜質,將食鹽樣品溶于水,依次加入稍過量的三種溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反應后過濾,得濾渣X,向濾液中加入過量的稀鹽酸,攪拌、煮沸,得氯化鈉溶液。下列說法正確的是( )A.濾渣X中有三種成分 B.“向濾液中加入過量的稀鹽酸”目的只是為了除去過量的NaOH C.除雜過程中有Na2CO3參加的化學反應為復分解反應 D.將氯化鈉溶液用題圖裝置加熱蒸發,至水分完全蒸干時停止加熱 發布:2024/12/25 15:30:1組卷:739引用:8難度:0.5 -
2.在“粗鹽的初步提純”實驗中,下列操作正確的是( )
A. 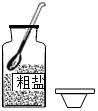
取用B. 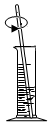
溶解C. 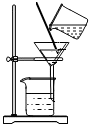
過濾D. 
蒸發發布:2024/12/25 16:0:1組卷:136引用:3難度:0.7 -
3.多角度認識溶液,有助于我們更好地了解其在生產生活中的重要作用.
(1)物質在水中的分散
①食鹽是重要的調味品,其主要成分氯化鈉是由構成的(選填“分子”、“原子”或“離子”),將適量食鹽加入水中,充分攪拌后能形成溶液.
②食用油加入水中,充分攪拌能形成乳濁液.洗潔精洗滌油膩的碗筷是利用原理.
③面粉加入水中,充分攪拌后能形成懸濁液.除去懸濁液中難溶性的面粉可用的操作方法是.
(2)溶液的性質
①關于溶液的說法正確的有(填標號).
A.鹽酸是純凈物 B.溶液是均一、穩定的
C.溶液的酸堿度可用石蕊溶液測定 D.飽和溶液不一定是濃溶液
②有些固體物質溶解形成溶液后會呈現不同的顏色,如品紅溶液是紅色的,放入活性炭可使紅色褪去,這利用活性炭的作用.
③a,b兩種物質的溶解度曲線如圖1所示.下列說法正確的是
A.a物質的溶解度一定大于b物質的溶解度
B.將a溶液從t2℃時降溫到t1℃時,一定有晶體析出
C.t1℃時,a、b兩種物質飽和溶液的溶質質量分數相等
D.將t2℃時b的飽和溶液變為不飽和溶液,可采取降溫的方法
(3)溶液的變化
將一定質量的飽和氯化鈉溶液通電一段時間后,下列敘述正確的是
通電
(反應原理為:2NaCl+2H2O═2NaOH+H2↑+Cl2↑)
A.溶液的pH逐漸減小 B.溶液中鈉元素的質量增大
C.溶液中氧元素的質量分數不變 D.氯化鈉溶液的溶質質量分數減小
(4)如圖2是“粗鹽中難溶性雜質的去除”的實驗操作示意圖:
①儀器a的名稱.
②操作A中托盤兩邊各放一張大小相同的紙片,其作用是.
③操作B中還需要用到的儀器是.
④操作 C過濾時倒入液體的液面要低于濾紙邊緣主要是為了防止(填字母).
A.過濾速度慢 B.濾紙破損 C.雜質未經過濾就進入濾液
⑤圖中部分操作有錯誤,其中有的錯誤會導致精鹽產率明顯偏低,其原因是.發布:2025/1/1 8:0:2組卷:55引用:1難度:0.5


