學習完金屬的化學性質,同學們來到實驗室進行鋅、銅、銀三種金屬活動性順序的探究活動。實驗桌上老師提供的藥品有:鋅片、銅片、銀片、硫酸鋅溶液、硫酸銅溶液、硝酸銀溶液和稀硫酸。
【制定計劃】在老師的指導下,經過討論,同學們設計出了以下幾種實驗方案:
方案一:銅片、硫酸鋅溶液、硝酸銀溶液;
方案二:鋅片、銀片、硫酸銅溶液;
方案三:鋅片、銅片、硫酸銅溶液、硝酸銀溶液;
你的設計方案是鋅片、銅片、稀硫酸、硝酸銀溶液(合理即可)鋅片、銅片、稀硫酸、硝酸銀溶液(合理即可)。
【進行實驗】小華同學選用方案三進行如下探究,請你幫他完成表格中的空白(注:表格中實驗操作一欄用文字描述或圖示表示均可):
| 實驗操作 | 實驗現象 | 分析與結論 |
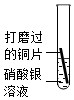 |
銅片表面附著一層銀白色物質,溶液由無色逐漸變為藍色 銅片表面附著一層銀白色物質,溶液由無色逐漸變為藍色 。 |
金屬活動性:Cu > > Ag(填“>”或“<”)。 |
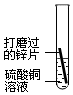  |
鋅片表面附著一層紅色物質,溶液由藍色逐漸變為無色。 | 金屬活動性:Zn > > Cu(填“>”或“<”),反應的化學方程式為Zn+CuSO4=Cu+ZnSO4 Zn+CuSO4=Cu+ZnSO4 。 |
Zn>Cu>Ag
Zn>Cu>Ag
。【反思與評價】探究活動結束后,同學們分享自己的收獲與不足,并進行反思:
1.有同學提出,小華的實驗中不用硫酸銅溶液也能得到相同的實驗結論。簡要說明其驗證方法:
將打磨過的鋅片放入銅片與硝酸銀反應后的溶液中,觀察鋅片表面是否出現紅色物質,溶液由藍色逐漸變為無色
將打磨過的鋅片放入銅片與硝酸銀反應后的溶液中,觀察鋅片表面是否出現紅色物質,溶液由藍色逐漸變為無色
。2.經過討論,大家一致認為以上實驗方案中,方案
一、二
一、二
較好。3.小華提出,試管中的金屬可以回收再利用,這樣做的意義是
節約金屬資源,防止造成環境污染
節約金屬資源,防止造成環境污染
。【拓展與延伸】好奇地小華在老師的指導下,把一定量的鋅粒加入硫酸銅和硝酸銀的混合溶液中,充分反應一段時間后,過濾,發現濾液呈無色。此時,濾渣中一定含有
銀和銅
銀和銅
,溶液中離子數目增加的是鋅離子
鋅離子
。【答案】鋅片、銅片、稀硫酸、硝酸銀溶液(合理即可);銅片表面附著一層銀白色物質,溶液由無色逐漸變為藍色;>; ;>;Zn+CuSO4=Cu+ZnSO4;Zn>Cu>Ag;將打磨過的鋅片放入銅片與硝酸銀反應后的溶液中,觀察鋅片表面是否出現紅色物質,溶液由藍色逐漸變為無色;一、二;節約金屬資源,防止造成環境污染;銀和銅;鋅離子
;>;Zn+CuSO4=Cu+ZnSO4;Zn>Cu>Ag;將打磨過的鋅片放入銅片與硝酸銀反應后的溶液中,觀察鋅片表面是否出現紅色物質,溶液由藍色逐漸變為無色;一、二;節約金屬資源,防止造成環境污染;銀和銅;鋅離子
 ;>;Zn+CuSO4=Cu+ZnSO4;Zn>Cu>Ag;將打磨過的鋅片放入銅片與硝酸銀反應后的溶液中,觀察鋅片表面是否出現紅色物質,溶液由藍色逐漸變為無色;一、二;節約金屬資源,防止造成環境污染;銀和銅;鋅離子
;>;Zn+CuSO4=Cu+ZnSO4;Zn>Cu>Ag;將打磨過的鋅片放入銅片與硝酸銀反應后的溶液中,觀察鋅片表面是否出現紅色物質,溶液由藍色逐漸變為無色;一、二;節約金屬資源,防止造成環境污染;銀和銅;鋅離子【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:731引用:10難度:0.5
相似題
-
1.根據圖示設計的實驗來進一步認識金屬的化學性質和金屬的活動性順序。
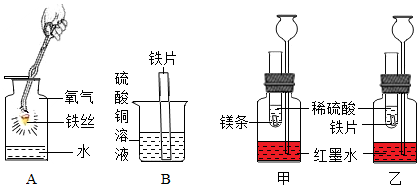
(1)寫出實驗A中反應的化學方程式:。
(2)實驗B中可觀察到鐵片的表面出現,說明鐵的金屬活動性比銅(填“強”或“弱”)。
(3)若想探究鎂、鐵、銅三種金屬的活動性強弱,小清同學提出在實驗B的基礎上增加實驗甲和乙,便可得出結論。試管內的鎂片和鐵片表面均被打磨潔凈,且形狀、大小相同;同時加入等質量和等濃度的稀硫酸。
①乙裝置中發生反應的化學方程式為。
②觀察到試管中有氣泡產生且長頸漏斗中甲的液面上升比乙(填“快”或“慢”)時,可以證明鎂的金屬活動性比鐵的強。
③若甲、乙實驗所用的金屬均過量,則甲裝置中產生的H2質量(填“大于”“小于”或“等于”)乙裝置中產生的H2質量。
④小亮同學指出若想探究這三種金屬的活動性強弱,只需使用三種藥品即可達到實驗目的,請你幫助小亮完成其實驗方案。操作 現象 結論 將鎂片和銅片分別放入氯化亞鐵溶液中 放入銅片的氯化亞鐵溶液中 ,放入鎂片的氯化亞鐵溶液的顏色由金屬的活動性強弱關系為Mg>Fe>Cu 發布:2024/12/7 8:0:1組卷:77引用:1難度:0.5 -
2.2019年版第五套人民幣5角硬幣的材質已由“鋼芯鍍銅合金”改為“鋼芯鍍鎳”,其表面色澤也因此由
色變為銀白色。化學興趣小組決定,探究制造5角硬幣的三種主要金屬(鐵、銅、鎳)活動性順序。
【查閱資料】
(1)硫酸鎳溶液顯綠色,Ni的化合價通常為+2價。
(2)鎳能與稀硫酸反應,生成硫酸鎳和氫氣。
【提出猜想】猜想①:;猜想②:Fe>Ni>Cu。
【實驗探究】
(1)甲組同學將一塊表面潔凈的鎳片放入稀硫酸中,觀察到的實驗現象是,有關反應的化學方程式是。
(2)乙組同學將一塊表面潔凈的鎳片浸入硫酸亞鐵溶液中,一會兒取出,發現鎳片表面無明顯變化,說明猜想(填“①”或“②”)成立。
(3)丙組同學用銅片、硫酸鎳溶液和進行實驗,也得出了三種金屬的活動性順序。
【拓展延伸】
(1)某電鍍公司的檢修員利用工作之便,將鎳網放入含有金鹽的電鍍液中偷偷“吸取”黃金,該盜竊手法利用了(填反應的基本類型)原理。該員工竊取貴重物品的行為,必將受到法律的制裁。
(2)金屬活動性實際上是金屬在水溶液中失去電子的能力大小。下列事實可以判斷M、N兩種金屬活動性順序的是(填序號)。
①M能和鹽酸反應而N不能
②M、N分別放入鹽酸中比較反應劇烈程度
③常溫下M能與氧氣反應而N不能
④M能從N的鹽溶液中置換出N發布:2024/12/25 14:0:2組卷:229引用:5難度:0.5 -
3.化學小組為探究鐵、銅、鋅、銀的金屬活動性順序,設計如下三個實驗(其中金屬均已打磨,其形狀、大小及同種稀鹽酸的用量均相同):
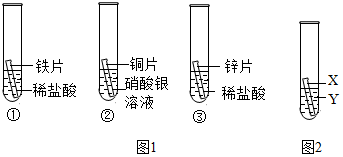
(1)實驗①的化學方程式為;一段時間后,觀察到實驗②的銅片表面有銀白色固體附著,這說明銅比銀的活動性(填“強”或“弱”)。
(2)甲同學認為通過實驗①和③可比較鋅和鐵的金屬活動性,他依據的實驗現象是。
(3)乙、丙兩位同學認為上述實驗方案不足以得出四種金屬的活動順序,并在上述實驗的基礎上,利用金屬
不同的化學性質分別補充了一個實驗(圖2所示),都實現了探究的目的。乙同學的實驗:X是金屬,Y是溶液;丙同學的實驗:X是金屬,Y是溶液。發布:2024/12/25 17:30:2組卷:45引用:4難度:0.5
相關試卷


