通過晾曬海水或煮鹽井水、鹽湖水等,可以蒸發除去水分得到粗鹽.粗鹽中含有難溶性雜質(泥沙等)和多種可溶性雜質(氯化鎂、氯化鈣等).
[提出問題]如何才能將粗鹽中難溶性雜質和可溶性雜質(氯化鎂、氯化鈣)除去,從而獲得較純的食鹽晶體?
[資料準備]
| 20℃時,一些物質的溶解度 | ||
| OH- | CO 2 - 3 |
|
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
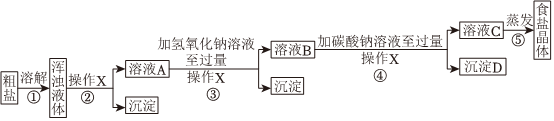
[交流與表達]
(1)實驗步驟①和②的目的是
除去粗鹽中的難溶性雜質
除去粗鹽中的難溶性雜質
;用化學方程式表示實驗步驟③的目的是 MgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
.(2)實驗操作X的名稱是
過濾
過濾
,該操作中要用到的玻璃儀器有燒杯、玻璃棒和 漏斗
漏斗
.(3)實驗步驟③中判斷氫氧化鈉溶液已過量的方法是
取樣品少許,加入試管中,滴加酚酞試液,溶液變紅色
取樣品少許,加入試管中,滴加酚酞試液,溶液變紅色
.(4)實驗步驟③中能否將氫氧化鈉換成氫氧化鋇?并說明理由
可以,鋇離子可以用過量的碳酸鈉溶液除去
可以,鋇離子可以用過量的碳酸鈉溶液除去
。(5)實驗步驟④中能否將碳酸鈉換成碳酸鉀?并說明理由
不能將碳酸鈉換成碳酸鉀,這樣會引入雜質離子鉀離子
不能將碳酸鈉換成碳酸鉀,這樣會引入雜質離子鉀離子
。(6)實驗步驟⑤用蒸發溶劑的方法而不用降低溶液溫度的方法獲取食鹽晶體,原因是
氯化鈉的溶解度受溫度影響較小
氯化鈉的溶解度受溫度影響較小
;在蒸發食鹽溶液的過程中要使用玻璃棒,作用是 攪拌溶液,避免因局部過熱,造成液滴飛濺
攪拌溶液,避免因局部過熱,造成液滴飛濺
.(7)過濾之后若要洗滌沉淀,應該進行的操作是
沿玻璃棒向過濾器中加水,至水剛好浸沒沉淀,使水自然留下,重復操作2-3次
沿玻璃棒向過濾器中加水,至水剛好浸沒沉淀,使水自然留下,重復操作2-3次
。[反思與評價]
(8)有同學認為只需要用氫氧化鈉溶液和碳酸鈉溶液中任意一種試劑就能將兩種可溶性雜質出去,你認為這種方法是否可行?并說明理由是
這種方法不可行,因為MgCO3、Ca(OH)2均為微溶物,只用任意一種試劑就會有一種雜質生成微溶物而不能全部除去
這種方法不可行,因為MgCO3、Ca(OH)2均為微溶物,只用任意一種試劑就會有一種雜質生成微溶物而不能全部除去
.(9)有同學認為原實驗方案不完善,做出這種評價的依據是
做出這種評價的依據是:在除去MgCl2和CaCl2的同時,又引入了新的雜質NaOH和Na2CO3.
做出這種評價的依據是:在除去MgCl2和CaCl2的同時,又引入了新的雜質NaOH和Na2CO3.
.為了完善原實驗方案,你設計的實驗是 設計的實驗是:向溶液C中逐滴加入稀鹽酸至不再產生氣泡,滴加酚酞試液時溶液不變色
設計的實驗是:向溶液C中逐滴加入稀鹽酸至不再產生氣泡,滴加酚酞試液時溶液不變色
(僅寫出補充部分的實驗操作和現象)。(10)完善該方案之后,小明同學將所得的食鹽晶體溶于水形成溶液后,再向該溶液中滴加氯化鋇,發現產生了白色沉淀,于是他下結論說所制得的食鹽中含有硫酸根離子,你是否同意它的判斷?
否
否
(填是或否)(11)若實驗過程中氯化鈉均沒有損耗,則所得到的氯化鈉的量和最開始粗鹽中的氯化鈉的量,誰更多?為什么?
所得到的氯化鈉的量會更多,因為CaCl2~2NaCl,用46g代替40g,MgCl2~2NaCl,用46g代替24g,并且加入的氫氧化鈉和碳酸鈉中的鈉元素和鹽酸中的氯元素也會生成氯化鈉
所得到的氯化鈉的量會更多,因為CaCl2~2NaCl,用46g代替40g,MgCl2~2NaCl,用46g代替24g,并且加入的氫氧化鈉和碳酸鈉中的鈉元素和鹽酸中的氯元素也會生成氯化鈉
。[相關計算]
用所制得的食鹽配制溶質質量分數為1%,物質的量濃度為1mol/L的食鹽溶液10ml,計算出該10ml溶液的質量是
58.5g
58.5g
。【考點】粗鹽提純.
【答案】除去粗鹽中的難溶性雜質;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;過濾;漏斗;取樣品少許,加入試管中,滴加酚酞試液,溶液變紅色;可以,鋇離子可以用過量的碳酸鈉溶液除去;不能將碳酸鈉換成碳酸鉀,這樣會引入雜質離子鉀離子;氯化鈉的溶解度受溫度影響較小;攪拌溶液,避免因局部過熱,造成液滴飛濺;沿玻璃棒向過濾器中加水,至水剛好浸沒沉淀,使水自然留下,重復操作2-3次;這種方法不可行,因為MgCO3、Ca(OH)2均為微溶物,只用任意一種試劑就會有一種雜質生成微溶物而不能全部除去;做出這種評價的依據是:在除去MgCl2和CaCl2的同時,又引入了新的雜質NaOH和Na2CO3.;設計的實驗是:向溶液C中逐滴加入稀鹽酸至不再產生氣泡,滴加酚酞試液時溶液不變色;否;所得到的氯化鈉的量會更多,因為CaCl2~2NaCl,用46g代替40g,MgCl2~2NaCl,用46g代替24g,并且加入的氫氧化鈉和碳酸鈉中的鈉元素和鹽酸中的氯元素也會生成氯化鈉;58.5g
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:17引用:1難度:0.6
相似題
-
1.為了除去KCl溶液中少量的MgCl2、MgSO4雜質,可選用Ba(OH)2溶液、稀鹽酸和K2CO3溶液三種試劑,按圖步驟操作:
溶液加過量A濾液加過量B操作Ⅰ加過量C較純凈的KCl溶液加熱煮沸
(1)寫出下列試劑的化學式:A,C
(2)根據題意,回答下列問題:
①加入過量A的目的是,
②加入過量B的目的是,
③加熱煮沸的目的是,
(3)操作Ⅰ的名稱是。發布:2024/12/14 8:0:2組卷:53引用:1難度:0.6 -
2.除去粗鹽中的雜質 CaCl2、MgCl2和 Na2SO4,過程如下:

下列有關說法中,不正確的是( )A.除去 Mg2+的主要反應:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl B.試劑①一定不是Na2CO3溶液 C.檢驗 是否除凈:取少量濾液,加稀鹽酸酸化,再加 BaCl2溶液SO2-4D.濾液加稀鹽酸時只發生反應:HCl+NaOH=H2O+NaCl 發布:2024/12/30 4:0:1組卷:123引用:11難度:0.8 -
3.通過海水晾曬可得粗鹽,粗鹽除NaCl外,還含有MgCl2、CaCl2、Na2SO4以及泥沙等雜質,粗鹽精制的實驗流程如下。下列說法不正確的是( )
A.在第①步中使用玻璃棒攪拌可加速粗鹽溶解 B.第⑤步操作是過濾 C.在第②③④⑥步通過加入化學試劑除雜,加入試劑順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀鹽酸 D.除去MgCl2的離子方程式為:Mg2++2OH-=Mg(OH)2↓ 發布:2024/12/30 4:30:1組卷:91引用:5難度:0.8


