利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想在工業上已成為現實。某化學興趣小組在實驗室中模擬上述過程,其設計的模擬裝置如圖,根據設計要求回答:
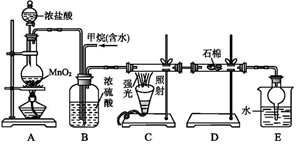
(1)A中發生反應的離子方程式為MnO2+4H++2Cl- 加熱 Mn2++Cl2↑+2H2OMnO2+4H++2Cl- 加熱 Mn2++Cl2↑+2H2O。
(2)B裝置有三種功能:①均勻混合氣;②干燥混合氣體;③控制氣流速度(或調整混合氣的比例)控制氣流速度(或調整混合氣的比例)。
(3)設V(Cl2)V(CH4)=x,若理論上欲獲得最多的氯化氫,則x值應≥44。
(4)E裝置的作用是吸收氯化氫和防止倒吸吸收氯化氫和防止倒吸。
(5)在C裝置中,經過一段時間的強光照射,發現硬質玻璃管內壁有黑色小顆粒產生,寫出生成黑色小顆粒的化學方程式:CH4+2Cl2光照C+4HClCH4+2Cl2光照C+4HCl。
(6)D裝置中的石棉上放較多的KI粉末,其作用為除去未反應的氯氣除去未反應的氯氣。
(7)E裝置除生成鹽酸外,還含有有機物,從E中分離出有機物的最佳方法為分液分液。
加熱
加熱
V
(
C
l
2
)
V
(
C
H
4
)
光照
光照
【答案】MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;控制氣流速度(或調整混合氣的比例);4;吸收氯化氫和防止倒吸;CH4+2Cl2C+4HCl;除去未反應的氯氣;分液
加熱
光照
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:38引用:1難度:0.7
相似題
-
 1.甲烷與氯氣在光照條件下發生反應(裝置如圖),實驗現象及解釋均正確的是
1.甲烷與氯氣在光照條件下發生反應(裝置如圖),實驗現象及解釋均正確的是
( )現象 解釋 A 量筒內氣體顏色逐漸變淺 甲烷被氯氣還原 B 量筒內出現少量白霧 生成HCl氣體 C 量筒內壁產生油狀液滴 油狀液體是CCl4 D 量筒內壁產生油狀液滴 生成液態產物 A.A B.B C.C D.D 發布:2024/11/24 12:30:6組卷:137引用:1難度:0.7 -
 2.如圖是研究甲烷取代反應實驗裝置圖,具體的實驗方法是:取一個100mL的大量筒,用排飽和食鹽水的方法先后收集20mLCH4和80mLCl2,進行實驗.
2.如圖是研究甲烷取代反應實驗裝置圖,具體的實驗方法是:取一個100mL的大量筒,用排飽和食鹽水的方法先后收集20mLCH4和80mLCl2,進行實驗.
(1)若研究甲烷與氯氣的取代反應,還需要的條件是.
(2)若將如圖所示裝置放在光亮的地方,等待片刻,觀察到的現象是.
(3)若將如圖所示裝置放在強光下照射會有(填可能發生的不良后果).
(4)若量筒中的甲烷和氯氣的量比較大,放在光亮的地方足夠長的時間,除看到(2)的現象外,還能看到的現象是.發布:2024/11/15 8:0:2組卷:635引用:1難度:0.7 -
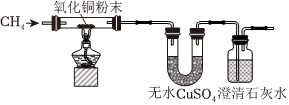 3.研究性學習小組進行CH4的性質探究實驗。
3.研究性學習小組進行CH4的性質探究實驗。
(1)通入高錳酸鉀酸性溶液,現象是。
(2)在無色玻璃集氣瓶中與Cl2混合后光照,現象是。
(3)為了驗證CH4是否具有還原性,某小組設計了如下實驗:
實驗過程中還觀察到無水CuSO4逐漸變藍,澄清石灰水出現渾濁現象,則CH4與CuO反應的化學方程式為。
(4)研究小組將CH4通入溴水時,發現溴水逐漸褪色,你認為原因可能是。請設計一個實驗方案證明你的結論(用文字表示,不必畫實驗裝置圖)。發布:2024/6/27 10:35:59組卷:365引用:4難度:0.5


