用98%的濃H2SO4(ρ=1.84g?cm-3)配制1mol?L-1稀H2SO4 100mL。
(1)實驗中應選用的儀器是(填字母) CEFGHCEFGH。
A.100mL量筒 B.托盤天平
C.玻璃棒D.50mL容量瓶
E.10mL量筒F.50mL燒杯
G.100mL容量瓶H.膠頭滴管
(2)實驗操作
①用100mL量筒量取98%的濃H2SO45.45.4 mL;
②選取對應規格的容量瓶,洗滌,檢查是否漏液,將稀釋并冷卻至室溫的H2SO4沿玻璃棒轉移到此容量瓶中;
③用少量蒸餾水洗滌小燒杯和玻璃棒2~3次,并將洗滌液轉移到容量瓶中;
④在小燒杯內稀釋濃H2SO4,稀釋時要用玻璃棒不斷攪拌;
⑤向容量瓶中直接加蒸餾水至離刻度線1cm~2cm處;
⑥蓋上容量瓶塞子、搖勻;
⑦用膠頭滴管小心加蒸餾水至刻度線;
⑧將配制好的溶液轉入洗滌但尚未干燥的試劑瓶中貯存備用。
(3)實驗分析
①正確的操作步驟是(填序號) ①④②③⑤⑦⑥⑧①④②③⑤⑦⑥⑧。
②此實驗中玻璃棒的作用是 攪拌和引流攪拌和引流。
③實驗操作有三處錯誤,這三處錯誤是:
Ⅰ. ①用100mL量筒量取98%的濃H2SO4①用100mL量筒量取98%的濃H2SO4。
Ⅱ. ⑤向容量瓶中直接加蒸餾水至離刻度線1cm~2cm處⑤向容量瓶中直接加蒸餾水至離刻度線1cm~2cm處。
Ⅲ. ⑧將配制好的溶液轉入洗滌但尚未干燥的試劑瓶中貯存備用⑧將配制好的溶液轉入洗滌但尚未干燥的試劑瓶中貯存備用。
④下列操作所配溶液濃度是“偏高”、“偏低”還是“無影響”:
Ⅰ.稀釋后的濃H2SO4未經冷卻至室溫立即轉移到容量瓶中 偏高偏高。
Ⅱ.轉移硫酸后,小燒杯未洗滌 偏低偏低。
Ⅲ.定容時仰視容量瓶刻度線 偏低偏低。
Ⅳ.定容時,液面超過刻度線再用膠頭滴管吸出溶液至液面與刻度線相平 偏低偏低。
【考點】配制一定溶質質量分數溶液的方法.
【答案】CEFGH;5.4;①④②③⑤⑦⑥⑧;攪拌和引流;①用100mL量筒量取98%的濃H2SO4;⑤向容量瓶中直接加蒸餾水至離刻度線1cm~2cm處;⑧將配制好的溶液轉入洗滌但尚未干燥的試劑瓶中貯存備用;偏高;偏低;偏低;偏低
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:65引用:1難度:0.7
相似題
-
1.化學實驗是科學探究過程中的一種重要方法,掌握化學實驗的基本操作和物質的制備、轉化及性質的探究尤為重要,請結合所學化學實驗知識回答以下問題。
Ⅰ.實驗室配制220mL 1 mol?L-1的稀H2SO4溶液:
(1)用量筒量取濃H2SO4(密度為1.84g?mL-1,質量分數為98%)的體積為mL。
(2)誤差分析:下列情況使配制結果偏大的是。
①溶解后未冷卻即轉移、定容
②定容時仰視容量瓶刻度線
③用量筒量取一定體積的濃硫酸時俯視
④將量筒、燒杯、玻璃棒洗滌2~3次,轉移至容量瓶
Ⅱ.某研究性學習小組在查閱資料時發現:化工廠常用氨氣來檢驗氯氣是否泄漏。于是他們設計實驗探究氯氣與氨氣之間的反應。制備氣體的實驗裝置有如圖1(可重復選用):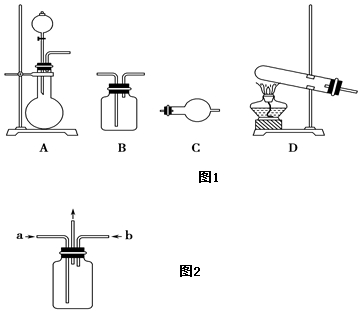
實驗藥品有:a.MnO2(s) b.濃鹽酸 c.NH4Cl(S) d.KClO3(s) e.堿石灰f。濃硫酸 g.飽和食鹽水 h.NaOH(s) i.消石灰
請回答下列問題。
(1)利用上述實驗裝置與藥品制備干燥氨氣,應選用的裝置有(填字母序號)。發生反應的化學方程式為。
(2)制取干燥氯氣的裝置由A、B、B組裝而成,則B中應裝的試劑依次是(填字母序號)。
(3)為使氯氣、氨氣在如圖2所示裝置中充分混合并反應,在a口通入的氣體是,若氨氣量較多,則瓶內會出現大量白煙,該白煙為。
(4)已知,在水溶液中能發生反應3Cl2+2NH3═N2+6HCl,若氯氣過量,氯氣與氨氣反應生成兩種化合物,其中一種化合物分子的空間構型與NH3相似,則該反應的化學方程式為。發布:2024/6/27 10:35:59組卷:122引用:1難度:0.5 -
2.用K2Cr2O7固體配制K2Cr2O7溶液,并用Na2S2O3溶液標定K2Cr2O7溶液的濃度,主要操作步驟:先稱量3.0gK2Cr2O7固體,再配成一定物質的量濃度的K2Cr2O7溶液,后加入過量KI和適量稀硫酸,充分反應后,用標準Na2S2O3溶液滴定。上述操作中,不需要使用的儀器是( )
A. 
B. 
C. 
D.  發布:2024/5/27 14:0:0組卷:54引用:5難度:0.8
發布:2024/5/27 14:0:0組卷:54引用:5難度:0.8 -
3.用固體樣品配制一定物質的量濃度的溶液,需經過溶解、轉移、定容、搖勻等操作。下列圖示對應的操作不規范的是( )
A. 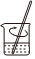
溶解B. 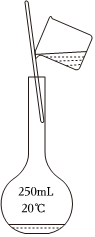
轉移C. 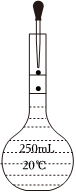
定容D. 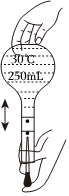
搖勻發布:2024/5/27 14:0:0組卷:497引用:9難度:0.9


