 滴定法是化學分析的常用方法,是一種簡便、快速和應用廣泛的定量分析方法,在常量分析中有較高的準確度。酸堿滴定和氧化還原滴定是常見的兩種滴定方法:
滴定法是化學分析的常用方法,是一種簡便、快速和應用廣泛的定量分析方法,在常量分析中有較高的準確度。酸堿滴定和氧化還原滴定是常見的兩種滴定方法:
Ⅰ.氧化還原滴定:雙氧水常用于醫(yī)用傷口消毒、環(huán)境消毒和食品消毒。化學興趣小組欲準確測定某市售雙氧水中H2O2的含量:取雙氧水25.00 mL至錐形瓶中,加入稀硫酸酸化,用蒸餾水稀釋。用一定濃度的高錳酸鉀標準液滴定,其反應的離子方程式為2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O。
(1)滴定時,將高錳酸鉀標準溶液注入 酸酸(填“酸”或“堿”)式滴定管中。
(2)滴定到達終點的現(xiàn)象是 滴入最后一滴高錳酸鉀溶液,溶液呈紫色,且30秒內(nèi)不褪色滴入最后一滴高錳酸鉀溶液,溶液呈紫色,且30秒內(nèi)不褪色。
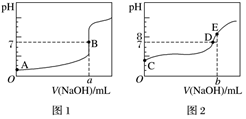
Ⅱ.酸堿中和滴定:常溫下,用0.1000mol?L-1NaOH溶液分別滴定20.00mL等濃度的鹽酸和醋酸溶液,得到兩條滴定曲線,如圖所示。
(1)滴定鹽酸的曲線是圖 11(填“1”或“2”)。
(2)達到B、D狀態(tài)時,反應消耗的NaOH溶液的體積a >>(填“>”“<”或“=”)b。
(3)D狀態(tài)時,溶液中的溶質(zhì)是 CH3COONa,CH3COOHCH3COONa,CH3COOH。
【考點】利用滴定法測定物質(zhì)含量的實驗.
【答案】酸;滴入最后一滴高錳酸鉀溶液,溶液呈紫色,且30秒內(nèi)不褪色;1;>;CH3COONa,CH3COOH
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:79引用:3難度:0.7
相似題
-
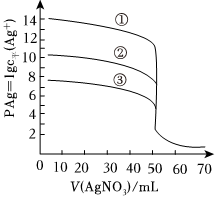 1.25℃時,用0.1000mol?L-1的AgNO3溶液分別滴定體積均為V0 mL且濃度均為0.1000mol?L-1的KCl、KBr及KI溶液,其滴定曲線如圖。已知:25℃時,AgCl、AgBr及AgI溶度積常數(shù)依次為1.8×10-10mol 2?L-2、5.0×10-13mol 2?L-2、8.3×10-17mol 2?L-2,下列說法正確的是( )
1.25℃時,用0.1000mol?L-1的AgNO3溶液分別滴定體積均為V0 mL且濃度均為0.1000mol?L-1的KCl、KBr及KI溶液,其滴定曲線如圖。已知:25℃時,AgCl、AgBr及AgI溶度積常數(shù)依次為1.8×10-10mol 2?L-2、5.0×10-13mol 2?L-2、8.3×10-17mol 2?L-2,下列說法正確的是( )A.當AgNO3溶液滴定至60.00mL時,溶液中c平(I-)<c平(Br-)<c平(Cl-) B.V0=45.00 C.滴定曲線①表示KCl的滴定曲線 D.滴定KCl時,可加入少量的KI作指示劑 發(fā)布:2024/4/20 14:35:0組卷:51引用:1難度:0.6 -
2.乙二酸(H2C2O4)俗稱草酸,是二元弱酸,在實驗研究和化學工業(yè)中應用廣泛。回答下列問題:
Ⅰ.查閱資料可知,常溫下,部分弱酸的電離平衡常數(shù)如下表:
(1)常溫下,pH=11的NaOH溶液與pH=3的氫氟酸溶液等體積混合,溶液顯弱酸 HF H2C2O4 電離平衡常數(shù) Ka=6.3×10-4 Ka1=5.6×10-2
Ka2=1.5×10-4性(填“酸”“堿”或“中”)。
(2)向等體積、等pH的草酸和氫氟酸溶液中加入大小相同的鋅粒,初始速率分別是v1、v2,其大小關系為v1v2(填“>”“<”或“=”)。
(3)向Na2C2O4溶液中通入過量的HF,反應的化學方程式為。
Ⅱ.已知草酸晶體(H2C2O4?XH2O)可溶于水,并可與酸性高錳酸鉀溶液完全反應:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。現(xiàn)用氧化還原滴定法測定草酸晶體的結晶水分子數(shù)X,步驟如下:
①用分析天平稱取草酸晶體1.260g,將其配制成100.00mL待測草酸溶液
②用移液管移取25.00mL待測草酸溶液于錐形瓶中,并加入適量硫酸酸化
③用濃度為0.1000mol/L的KMnO4標準溶液進行滴定,三次結果如下:
已知:H2C2O4的相對分子質(zhì)量為90。第一次滴定 第二次滴定 第三次滴定 待測溶液體積(mL) 25.00 25.00 25.00 標準溶液體積(mL) 9.99 10.01 10.00
(1)滴定時,KMnO4標準溶液應該裝在(填“酸式”或“堿式”)滴定管中。
(2)到達滴定終點的標志是。
(3)根據(jù)上述數(shù)據(jù)計算X=。
(4)誤差分析:若滴定開始時仰視滴定管刻度,滴定結束時俯視滴定管刻度,則X值(填“偏高”“偏低”或“無影響”)。發(fā)布:2024/6/27 10:35:59組卷:108引用:1難度:0.5


