 對微觀粒子的研究打開了新世界的大門,每一種微觀粒子的應用都給我們的文明帶來了重大變革。
對微觀粒子的研究打開了新世界的大門,每一種微觀粒子的應用都給我們的文明帶來了重大變革。
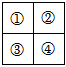
(1)已知四種短周期主族元素在周期表中相對位置如圖所示。下列說法正確的是 BDBD。
A.②、④兩元素的最高化合價一定相等
B.①、③原子序數差一定等于8
C.③、④的最高價氧化物對應的水化物一定能反應
D.若①的最外層電子數是核外電子層數的3倍,則②的單質一定具有強氧化性
(2)下列化學用語正確的是 ADAD。
A.CO2分子的電子式為: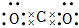
B.核內質子數為117,核內中子數為174的核素Ts可表示為: 174117Ts
C.Cl-的離子結構示意圖為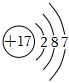
D.HClO的結構式為H-O-Cl
(3)現有下列物質:①H2②Na2O2③NaOH④H2O2⑤CaCl2⑥NH4NO3⑦H2S,只由離子鍵構成的物質是 ⑤⑤(填序號,下同),屬于共價化合物的是 ④⑦④⑦。
(4)某元素的一種同位素X的質量數為A,含N個中子,它與1H原子組成HX分子,在a克HmX分子中含質子的物質的量是 aA+m×(A-N+m)aA+m×(A-N+m)。
(5)X、Y、Z、W為原子序數依次增大的四種短周期主族元素,X、Y、Z原子最外層的電子數之和與W原子最外層的電子數相等,X的最低負價為-4,Y的周期數是族序數的3倍。下列說法正確的是 AA。
A.原子半徑:Y>Z>X
B.Y的最高價氧化物對應的水化物的堿性比Z的弱
C.W的氧化物對應的水化物的酸性一定比X的強
D.W分別與X、Z形成的化合物所含的化學鍵類型相同
174
117
a
A
+
m
×
(
A
-
N
+
m
)
a
A
+
m
×
(
A
-
N
+
m
)
【答案】BD;AD;⑤;④⑦;;A
a
A
+
m
×
(
A
-
N
+
m
)
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/12/20 19:30:2組卷:71引用:1難度:0.7
相似題
-
1.X、Y、Z、M、N均為短周期主族元素,原子序數依次增大。X是宇宙中含量最高的元素,YX3分子呈三角錐形,Z的價電子排布式為nsnnpn+2,五種元素中M的電負性最小,N的最高價含氧酸酸性最強。下列說法正確的是( )
A. 的VSEPR模型為V形YZ-2B.由X、Y、Z三種元素組成的化合物的水溶液均顯酸性 C.同周期中第一電離能大于Z的元素有3種 D.MN晶體中M離子的配位數為8 發布:2025/1/5 8:0:1組卷:47引用:1難度:0.5 -
2.A、B、C、D、E為原子序數依次增大的五種短周期元素;A是宇宙中最豐富的元素且與E同主族;B位于元素周期表ⅣA族;C在元素周期表中與B、D相鄰;D基態原子的s軌道與p軌道的電子總數相等且p軌道有2個未成對的電子;E是短周期中原子半徑最大的元素;F原子核外電子數為29.回答下列問題:
(1)F基態原子的核外電子排布式為。
(2)A、B、C、D、E五種元素中,電負性最小的元素為(填元素符號,下同),第一電離能最大的元素為;A3D+的立體構型為。
(3)A、B可形成多種化合物,其中相對分子質量為28的分子,其中心原子的雜化方式為,該分子中σ鍵和π鍵的數目之比為。
(4)化合物BD2和E2D2的晶體類型分別為、。
(5)F單質為面心立方晶體,若F的相對原子質量為M,阿伏加德羅常數為NA,晶胞邊長為a cm,則晶體F的密度ρ=g?cm-3。發布:2025/1/18 8:0:1組卷:27引用:2難度:0.3 -
3.已知A、B、C、D、E、F、G都是短周期的元素,它們的原子序數依次遞增.A原子的電子層數與它的核外電子總數相同,而B原子的最外層電子數是次外層的2倍,C的氫化物可使濕潤的紅色石蕊試紙變藍,B和D可以形成兩種氣態化合物,E原子核外電子總數比B的2倍少1,D與F同主族,G的原子半徑是本周期元素中最小的.則:
(1)A元素為C元素為E元素為
(2)由上述元素形成的10電子分子有、.
(3)由B和D以質量比為3:8組成的化合物與E的同周期相鄰主族元素的單質反應的化學方程式為.
(4)G單質與E的最高價氧化物的水化物反應的離子方程式為
(5)B、C、D形成的氣態氫化物中,較穩定的是
(6)由A、C、G形成的離子化合物的化學式是.發布:2024/12/30 18:30:1組卷:7引用:3難度:0.5


