 金屬用途廣泛,其結構和性質等是化學研究的重要內容。
金屬用途廣泛,其結構和性質等是化學研究的重要內容。
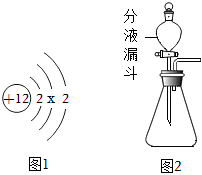
(1)鎂常用于國防工業。如圖1是鎂的原子結構示意圖,下列說法不正確的是 CC(填字母)。
A.鎂原子的核外電子數為12
B.在化合物中鎂通常顯+2價
C.圖中“x”的值為10
D.鎂位于元素周期表中第三周期
(2)地殼中含量最高的金屬元素可用于制作蒸鍋,主要利用了金屬的延展性和 導熱性導熱性性;該金屬制品具有較好的耐腐蝕性,用化學方程式表示原因:4Al+3O2=2Al2O34Al+3O2=2Al2O3。
(3)如圖2所示裝置可以用于多種氣體的實驗室制取。
①實驗室用該裝置制取氫氣,反應的化學方程式是 Zn+H2SO4=ZnSO4+H2↑Zn+H2SO4=ZnSO4+H2↑。
②制取CO2后,檢驗裝置內的廢液是否顯酸性,可選用的試劑(或用品)較多,如紫色石蕊溶液、pH試紙、氧化銅和金屬等。請寫出一種滿足要求的金屬鐵鐵。
(4)向一定量AgNO3和Cu(NO3)2混合溶液中加入鋅粉,充分反應后過濾,得到溶液A和固體B。
①寫出一定發生的反應的化學方程式 Zn+2AgNO3=Zn(NO3)2+2AgZn+2AgNO3=Zn(NO3)2+2Ag。
②溶液A中的溶質不可能是Zn(NO3)2、AgNO3,其理由是什么?金屬活潑性:Zn>Cu>Ag,所以向一定量AgNO3和Cu(NO3)2混合溶液中加入鋅粉,若硝酸銀有剩余,則溶液的溶質中一定存在Zn(NO3)2、Cu(NO3)2、AgNO3金屬活潑性:Zn>Cu>Ag,所以向一定量AgNO3和Cu(NO3)2混合溶液中加入鋅粉,若硝酸銀有剩余,則溶液的溶質中一定存在Zn(NO3)2、Cu(NO3)2、AgNO3
(5)鐵制品容易生銹,造成資源浪費。某工廠消耗質量分數為10%的廢硫酸49t來除銹,并回收生成的鹽。理論上可回收鹽的質量是多少?(假設金屬單質不參與反應,結果保留到0.1t)
【答案】C;導熱性;4Al+3O2=2Al2O3;Zn+H2SO4=ZnSO4+H2↑;鐵;Zn+2AgNO3=Zn(NO3)2+2Ag;金屬活潑性:Zn>Cu>Ag,所以向一定量AgNO3和Cu(NO3)2混合溶液中加入鋅粉,若硝酸銀有剩余,則溶液的溶質中一定存在Zn(NO3)2、Cu(NO3)2、AgNO3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:19引用:1難度:0.6
相似題
-
1.從古至今,鐵都被廣泛使用。下列敘述中不正確的是( )
A.生鐵屬于合金 B.鐵不能與硝酸銀溶液反應 C.鐵由鐵原子構成 D.鐵能制成鐵鍋用來炒菜 發布:2025/1/1 8:0:2組卷:66引用:2難度:0.5 -
2.從古至今,鐵都被廣泛使用.下列敘述中,不正確的是( )
A.生鐵屬于合金 B.鐵可以在氧氣中燃燒 C.鐵能跟硝酸銀溶液反應 D.鐵在潮濕的環境中不易生銹 發布:2025/1/1 8:0:2組卷:4引用:3難度:0.9 -
3.從古至今,鐵都被廣泛使用.下列敘述中,不正確的是( )
A.生鐵屬于合金 B.鐵可以在氧氣中燃燒 C.鐵能跟硝酸銀溶液反應 D.煉鐵的過程是把鐵礦石變成純凈的氧化鐵 發布:2025/1/1 8:0:2組卷:16引用:5難度:0.9


