二氧化碳是一種溫室氣體。某化學興趣小組利用如下圖所示裝置對二氧化碳的性質進行驗證:

(1)裝置A作為氣體發生裝置具有的優點是能控制反應的發生和停止能控制反應的發生和停止。
(2)裝置B用來證明CO2與水的反應,B中的未知溶液應為紫色石蕊溶液紫色石蕊溶液,實驗現象是紫色石蕊試液變紅紫色石蕊試液變紅,反應的化學方程式為CO2+H2O═H2CO3CO2+H2O═H2CO3。使裝置中顏色改變的物質是碳酸碳酸。
(3)裝置C中盛有澄清石灰水,通入二氧化碳的實驗現象是澄清石灰水變渾濁澄清石灰水變渾濁,反應的化學方程式為CO2+Ca(OH)2═CaCO3↓+H2OCO2+Ca(OH)2═CaCO3↓+H2O。
(4)在裝置D中的現象是下層的蠟燭先熄滅、上層的蠟燭后熄滅下層的蠟燭先熄滅、上層的蠟燭后熄滅,說明CO2具有不燃燒、不支持燃燒,密度比空氣大不燃燒、不支持燃燒,密度比空氣大的性質,這樣的性質在實際中可以用CO2來滅火滅火。
【答案】能控制反應的發生和停止;紫色石蕊溶液;紫色石蕊試液變紅;CO2+H2O═H2CO3;碳酸;澄清石灰水變渾濁;CO2+Ca(OH)2═CaCO3↓+H2O;下層的蠟燭先熄滅、上層的蠟燭后熄滅;不燃燒、不支持燃燒,密度比空氣大;滅火
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:66引用:1難度:0.1
相似題
-
1.以二氧化碳為例,學習科學家研究物質的方法。

(1)1630年,海爾蒙特發現二氧化碳能使燃著蠟燭熄滅,該變化體現二氧化碳的性質是。
(2)1755年,布萊克第一個運用定量方法研究二氧化碳,研究的主要過程如圖: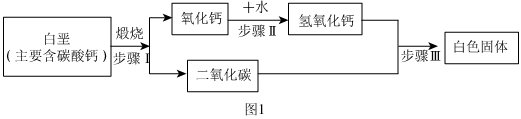
①白堊充分煅燒后(雜質不參與反應),固體減少的質量即為(填化學式)的質量。
②步驟Ⅲ生成的白色固體是(填名稱)。
③實驗室制取氣體部分儀器與裝置如圖: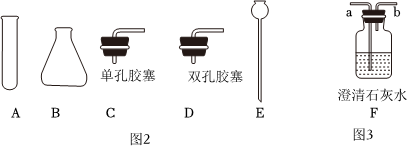
實驗室制備二氧化碳的符號表達式是。組裝連續產生較多氣體的發生裝置需選擇的儀器為(“A、B、C、D、E”中選填)。若要檢驗氣體是否為 CO2,應選擇裝置F,氣體應從(填“a′或“b”)處通入,反應的符號表達式是。
(3)1766年,卡文迪許測得:1體積水約能溶解1體積二氧化碳。圖4所示針筒內二氧化碳與水充分混合后,針筒內的上液面將停留在mL處。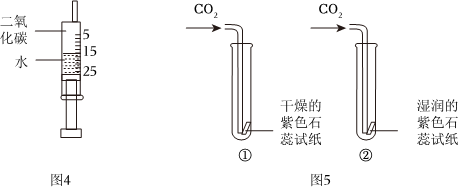
(4)圖5為模擬伯格曼實驗,試管(②的現象為。-你認為(填“有”或“沒有”)必要進行試管①的對比實驗。發布:2024/10/3 1:0:1組卷:234引用:1難度:0.5 -
2.可用同一化學原理解釋的現象是( )
①久置的石灰水,液面上出現一層硬殼狀薄膜
②通過吸管向澄清的石灰水中不斷吹入由人體呼出的氣體后,石灰水變渾濁
③為了使石灰漿刷過的墻壁快點干,在室內生起一盆炭火,開始時墻壁反而潮濕
④用鹽酸證明雞蛋殼的主要成分是碳酸鈣.A.①②③ B.①②④ C.①③④ D.②③④ 發布:2024/9/5 1:0:8組卷:44引用:2難度:0.9 -
 3.同學們在老師的指導下,從存在、性質、用途、制取等方面對二氧化碳進行了研究,較全面地認識了二氧化碳。請回答下列問題:
3.同學們在老師的指導下,從存在、性質、用途、制取等方面對二氧化碳進行了研究,較全面地認識了二氧化碳。請回答下列問題:
(1)二氧化碳和水一樣,也有三種狀態。固態二氧化碳升華時的熱量變化為。
(2)用澄清石灰水可檢驗二氧化碳,體現的化學原理為(用符號表達式表示)。
(3)與實驗室制取二氧化碳不同,工業制取二氧化碳采用高溫煅燒石灰石,碳酸鈣在高溫條件下會生成氧化鈣和二氧化碳,該反應為(填基本反應類型)。
(4)二氧化碳可用于制汽水、滅火,請寫出二氧化碳的另一種用途。
(5)“碳達峰”中的碳是指二氧化碳,從碳循環視角看,會導致大氣中二氧化碳含量增加的過程有(寫一種)。發布:2024/11/2 8:0:1組卷:11引用:2難度:0.5


