質量守恒定律是自然界普遍存在的基本定律之一,該定律還可推廣為:①氧化還原反應中的“電子得失守恒”:反應物中某元素得到的電子(元素化合價降低)總數等于另一元素失去的電子(元素化合價升高)總數;②溶液中的“電荷守恒”:陽離子帶的正電荷總量=陰離子帶的負電荷總量。請回答下列問題:
(1)在氧化還原反應KBr+KBrO3+H2SO4→Br2+K2SO4+H2O中,參加反應的KBr和KBrO3的化學計量數之比為 5:15:1;
(2)將KCl和KBr混合物53.6克溶于水配制成溶液,通入過量的Cl2反應,方程式為:2KBr+Cl2=2KCl+Br2,生成的Br2易揮發,將所得溶液蒸干得到固體44.7克。則原所配溶液中K+、Cl-、Br-的離子個數之比為DD。
A.1:1:1
B.5:2:3
C.2:3:1
D.3:2:1
以下是小濤同學解答該題的思路,請你一起幫忙完善。
①根據 溶液中的“電荷守恒”溶液中的“電荷守恒”可確定該題答案可能是B或D;
②通過計算進一步確定答案選 DD。計算過程:m(Br2)=53.6g-44.7g=8.9g,
設原混合溶液中KBr的質量為x,
2KBr+Cl2=2KCl+Br2
238160
x8.9g
238160=x8.9g
x≈13.2g
則原混合溶液中氯化鉀的質量為:53.6g-13.2g=40.4g。
因為氯化鉀的質量比溴化鉀的質量大,所以氯離子比溴離子多,在B選項中,氯離子和溴離子的個數比為2:3,不符合題意,在D選項中,氯離子和溴離子的個數比為2:1,符合題意,故選D。m(Br2)=53.6g-44.7g=8.9g,
設原混合溶液中KBr的質量為x,
2KBr+Cl2=2KCl+Br2
238160
x8.9g
238160=x8.9g
x≈13.2g
則原混合溶液中氯化鉀的質量為:53.6g-13.2g=40.4g。
因為氯化鉀的質量比溴化鉀的質量大,所以氯離子比溴離子多,在B選項中,氯離子和溴離子的個數比為2:3,不符合題意,在D選項中,氯離子和溴離子的個數比為2:1,符合題意,故選D。。
設原混合溶液中KBr的質量為x,
2KBr+Cl2=2KCl+Br2
238160
x8.9g
238
160
=
x
8
.
9
g
x≈13.2g
則原混合溶液中氯化鉀的質量為:53.6g-13.2g=40.4g。
因為氯化鉀的質量比溴化鉀的質量大,所以氯離子比溴離子多,在B選項中,氯離子和溴離子的個數比為2:3,不符合題意,在D選項中,氯離子和溴離子的個數比為2:1,符合題意,故選D。
設原混合溶液中KBr的質量為x,
2KBr+Cl2=2KCl+Br2
238160
x8.9g
238
160
=
x
8
.
9
g
x≈13.2g
則原混合溶液中氯化鉀的質量為:53.6g-13.2g=40.4g。
因為氯化鉀的質量比溴化鉀的質量大,所以氯離子比溴離子多,在B選項中,氯離子和溴離子的個數比為2:3,不符合題意,在D選項中,氯離子和溴離子的個數比為2:1,符合題意,故選D。
【考點】質量守恒定律及其應用.
【答案】5:1;D;溶液中的“電荷守恒”;D;m(Br2)=53.6g-44.7g=8.9g,
設原混合溶液中KBr的質量為x,
2KBr+Cl2=2KCl+Br2
238160
x8.9g
x≈13.2g
則原混合溶液中氯化鉀的質量為:53.6g-13.2g=40.4g。
因為氯化鉀的質量比溴化鉀的質量大,所以氯離子比溴離子多,在B選項中,氯離子和溴離子的個數比為2:3,不符合題意,在D選項中,氯離子和溴離子的個數比為2:1,符合題意,故選D。
設原混合溶液中KBr的質量為x,
2KBr+Cl2=2KCl+Br2
238160
x8.9g
238
160
=
x
8
.
9
g
x≈13.2g
則原混合溶液中氯化鉀的質量為:53.6g-13.2g=40.4g。
因為氯化鉀的質量比溴化鉀的質量大,所以氯離子比溴離子多,在B選項中,氯離子和溴離子的個數比為2:3,不符合題意,在D選項中,氯離子和溴離子的個數比為2:1,符合題意,故選D。
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:6引用:1難度:0.5
相似題
-
1.據美國《科學》雜志網站近日報道,科學家開發出一種新型催化劑,可借助光將二氧化碳轉化為甲烷,其化學反應可表示為:CO2+2X
CH4+2O2,這一方法是迄今最接近人造光合作用的方法。根據信息,以下說法正確的是( )光照催化劑A.該反應是置換反應 B.反應物X的化學式為H2O C.該反應是將化學能轉化為光能 D.反應前后,氧元素的化合價不變 發布:2024/12/19 2:30:1組卷:16引用:2難度:0.5 -
2.鋁是一種比較活潑的金屬,它與酸、堿均能反應產生氫氣。
(1)鋁與氫氧化鈉溶液反應生成氫氣的化學方程式為:2Al+2NaOH+2H2O═2NaAlO2+3H2↑。完成NaAlO2與適量鹽酸反應的化學方程式:NaAlO2+HCl+═Al(OH)3↓+NaCl。
(2)當鹽酸過量時,NaAlO2與鹽酸反應的化學方程式為:。發布:2024/12/20 14:0:1組卷:36引用:2難度:0.5 -
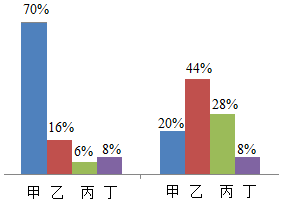 3.在密閉容器中有甲、乙、丙、丁四種物質,在一定條件下,測得反應前后各物質的質量分數如圖所示,下列說法錯誤的是( )
3.在密閉容器中有甲、乙、丙、丁四種物質,在一定條件下,測得反應前后各物質的質量分數如圖所示,下列說法錯誤的是( )A.乙可能是化合物 B.該反應是復分解反應 C.丁可能是該反應的催化劑 D.每消耗100g的甲,能生成44g的丙 發布:2024/12/16 7:0:2組卷:51引用:3難度:0.5


