某硫酸鈉粗品含有少量CaCl2和MgCl2,實驗室進行提純的流程如下:
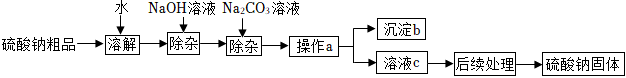
(1)加入NaOH溶液的目的是 除去MgCl2除去MgCl2。
(2)用Na2CO3溶液除雜時,發生反應的化學方程式為 Na2CO3+CaCl2=CaCO3↓+2NaClNa2CO3+CaCl2=CaCO3↓+2NaCl。
(3)操作a的名稱是 過濾過濾,若NaOH和Na2CO3溶液添加過量,可在操作a 后后(填“前”或“后”)加入適量的 稀硫酸或稀H2SO4稀硫酸或稀H2SO4(填名稱)除去。
(4)若“后續處理”的操作是蒸發,在進行該操作時,當蒸發皿中 出現較多固體時出現較多固體時即可停止加熱。蒸發時用玻璃棒攪拌,目的是 防止因局部溫度過高,造成液滴飛濺防止因局部溫度過高,造成液滴飛濺。若加入的NaOH和Na2CO3溶液為適量,上述流程仍存在一處明顯缺陷,請指出:沒有除去反應生成的NaCl沒有除去反應生成的NaCl。
(5)最終得到的硫酸鈉質量 >>(填“>”或“<”或“=”)硫酸鈉粗品中所含的硫酸鈉質量。
【答案】除去MgCl2;Na2CO3+CaCl2=CaCO3↓+2NaCl;過濾;后;稀硫酸或稀H2SO4;出現較多固體時;防止因局部溫度過高,造成液滴飛濺;沒有除去反應生成的NaCl;>
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/28 8:0:9組卷:10引用:2難度:0.5
相似題
-
1.新冠肺炎疫情防控期間,西安市各學校開展全域噴灑低濃度、有效成分是次氯酸鈉的“84”消毒液進行消毒。如圖所示是模擬制備“84”消毒液的流程(Cl2是一種黃綠色的有毒氣體)。請回答下列問題:
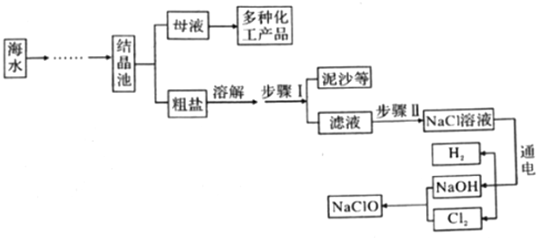
(1)NaOH的俗稱為(寫一種)。
(2)步驟Ⅱ中,通常用碳酸鈉溶液除去濾液中的氯化鈣雜質,請寫出有關反應的化學方程式。
(3)電解水時,一般在水中加入少量NaOH以增強水的導電性,不能加入NaCl的原因是。發布:2025/1/3 8:0:1組卷:6引用:1難度:0.5 -
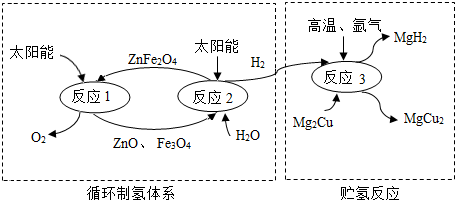 2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )
2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )A.ZnFe2O4中Fe的化合價為+3價 B.循環制氫反應中無需加入ZnFe2O4 C.反應1和反應2的總方程式為:2H2O 2H2↑+O2↑通電D.M與足量稀鹽酸反應生成的H2質量大于反應2產生的H2質量 發布:2024/12/31 8:0:1組卷:48引用:2難度:0.5 -
3.某種家用的消毒液的主要成分是次氯酸鈉(NaClO),制取NaClO的化學方程式為:Cl2+2NaOH=NaClO+NaCl+H2O,下列說法錯誤的是( )
A.NaClO中氯元素的化合價為-1 B.反應中用到的NaOH俗稱燒堿 C.該化學方程式中涉及到兩種鹽 D.反應前后氯元素化合價既升高又降低 發布:2025/1/3 8:0:1組卷:71引用:1難度:0.7


