2021年北京市朝陽(yáng)區(qū)高考化學(xué)二模試卷
發(fā)布:2024/4/20 14:35:0
一.第一部分每小題只有一個(gè)選項(xiàng)符合題意,每小題3分,共14道小題,共42分。
-
1.下列生活中的做法可以用氧化還原反應(yīng)規(guī)律解釋的是( )
A B C D 



用鐵粉作脫氧保鮮劑 用白醋去除水垢 用純堿溶液清洗油污 用明礬凈水 A.A B.B C.C D.D 組卷:94引用:2難度:0.8 -
2.下列關(guān)于氯及其化合物的說(shuō)法不正確的是( )
A.用石墨作電極電解飽和NaCl溶液,在陽(yáng)極產(chǎn)生Cl2 B.鐵絲在氯氣中燃燒,產(chǎn)生的棕黃色的煙主要成分為FeCl2 C.“84”消毒液與潔廁靈(主要成分為HCl)混用會(huì)產(chǎn)生Cl2 D.光照可促進(jìn)氯水中HClO分解,使溶液pH減小 組卷:176引用:5難度:0.6 -
3.用下列裝置進(jìn)行分離提純,主要利用的性質(zhì)與物質(zhì)溶解性無(wú)關(guān)的是( )
A B C D 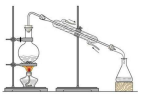
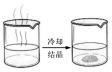
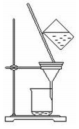
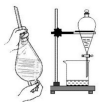
從海水中獲得蒸餾水 獲取苯甲酸晶體 去除粗鹽中的泥沙 用CCl4提取碘水中的I2 A.A B.B C.C D.D 組卷:33引用:3難度:0.5 -
4.銫為ⅠA族元素,核素
Cs是銫的一種放射性同位素,可用于癌癥治療。下列關(guān)于13755Cs的說(shuō)法,不正確的是( )13755A.質(zhì)量數(shù)為137 B.中子數(shù)為82 C.原子半徑:Cs>Na D.堿性:CsOH<KOH 組卷:86引用:2難度:0.8 -
5.Deacon催化氧化法將HCl轉(zhuǎn)化為Cl2的反應(yīng)為:
4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)△H=-116kJ?mol-1
研究發(fā)現(xiàn)CuCl2(s)催化反應(yīng)的過(guò)程如下:
反應(yīng)i:CuCl2(s)═CuCl(s)+Cl2(g)△H1=+83kJ?mol-112
反應(yīng)ii:CuCl(s)+O2(g)═CuO(s)+12Cl2(g)△H2=-20kJ?mol-112
反應(yīng)iii:……
下列表述不正確的是( )A.反應(yīng)i中反應(yīng)物的總能量小于生成物的總能量 B.反應(yīng)ii中,1mol CuCl(s)反應(yīng)時(shí)轉(zhuǎn)移2mol e- C.推斷反應(yīng)iii應(yīng)為CuO(s)+2HCl(g)═CuCl2(s)+H2O(g)△H3=-242kJ?mol-1 D.由反應(yīng)過(guò)程可知催化劑參與反應(yīng),通過(guò)改變反應(yīng)路徑提高反應(yīng)速率 組卷:113引用:5難度:0.6 -
6.下列化學(xué)用語(yǔ)對(duì)事實(shí)的表述不正確的是( )
A.電解法精煉銅的陰極反應(yīng):Cu2++2e-═Cu B.H和Cl形成共價(jià)鍵的過(guò)程: 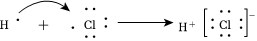
C.鉛蓄電池放電時(shí)的負(fù)極反應(yīng):Pb-2e-+ ═PbSO4SO2-4D.向FeSO4溶液中滴加NaOH溶液,產(chǎn)生白色沉淀,并最終變?yōu)榧t褐色:Fe2++2OH-═Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3 組卷:30引用:3難度:0.6
二.第二部分本部分共5題,共58分。
-
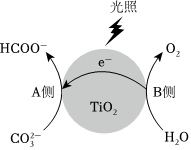 18.以TiO2為催化劑,在光照條件下可將還原為HCOO-等有機(jī)物。CO2-3
18.以TiO2為催化劑,在光照條件下可將還原為HCOO-等有機(jī)物。CO2-3
(1)制備TiO2:
TiCl4TiO2?xH2O大量熱水TiO2過(guò)濾、洗滌、脫水
TiCl4轉(zhuǎn)化為TiO2?xH2O的化學(xué)方程式是。
(2)光催化還原的反應(yīng)過(guò)程如圖所示。CO2-3
A側(cè)產(chǎn)生HCOO-的反應(yīng)式為。
在光照和TiO2存在下,以體積相同的0.25mol?L-1Na2CO3溶液為反應(yīng)物,相同時(shí)間后檢測(cè)HCOO-濃度,結(jié)果如表。
(3)推測(cè)實(shí)驗(yàn) 溶液中添加的其它成分 通入的氣體 c(HCOO-)/×10-5mol?L-1 i - - 73.5 ii - CO2 92.6 iii - O2 2.1 iv Na2SO3 - 158.1 也能在該條件下被還原為HCOO-,結(jié)合表中數(shù)據(jù)說(shuō)明推測(cè)的依據(jù):HCO-3。
(4)實(shí)驗(yàn)iii中HCOO-濃度明顯低于實(shí)驗(yàn)i,可能的原因是。
(5)研究實(shí)驗(yàn)iv中HCOO-濃度明顯高于實(shí)驗(yàn)i的原因,設(shè)計(jì)并完成實(shí)驗(yàn)v。實(shí)驗(yàn)v:光照條件下,未添加TiO2時(shí)重復(fù)實(shí)驗(yàn)iv,沒(méi)有檢測(cè)到。SO2-4
①實(shí)驗(yàn)v中檢測(cè)的操作和現(xiàn)象為SO2-4。
②對(duì)比實(shí)驗(yàn)iv、v,分析實(shí)驗(yàn)iv中Na2SO3的作用:(答出2點(diǎn))。組卷:48引用:2難度:0.5 -
19.工業(yè)上用鐵粉還原AgCl制取銀,某小組探究其過(guò)程和影響因素。
【實(shí)驗(yàn)A】在試管中加入NaCl溶液,然后滴入AgNO3溶液,產(chǎn)生白色沉淀。濾出白色沉淀,繼續(xù)實(shí)驗(yàn)如圖:
【資料】
①AgCl+Cl-?AgCl-2
②Fe3++4Cl-?FeCl-4
(1)檢驗(yàn)ⅱ中產(chǎn)物
①取ⅱ中上層清液,滴加K3[Fe(CN)6]溶液,(填現(xiàn)象),說(shuō)明溶液中含有Fe2+。
②取ⅱ中少量灰黑色固體,洗滌后將固體等分兩份。取其中一份,加入(填試劑)溶解,再加入NaCl溶液生成白色沉淀,證明灰黑色固體中含有Ag。向另一份加入KI溶液,無(wú)明顯現(xiàn)象。
(2)檢驗(yàn)ⅲ中產(chǎn)物。
①取ⅲ中灰白色固體,洗滌。進(jìn)行如圖實(shí)驗(yàn),確認(rèn)灰白色固體中含AgCl:
濾液加鹽酸未產(chǎn)生沉淀,但加入硫酸后產(chǎn)生了白色沉淀,請(qǐng)結(jié)合離子方程式解釋原因:。
②取iii中上層溶液,加幾滴KSCN溶液。取樣時(shí)間與溶液顏色如表。
用離子方程式表示溶液變紅的原因取樣時(shí)間 10分鐘 12小時(shí) 24小時(shí) 溶液顏色 淺紅色 紅色 深紅色 ,F(xiàn)e3++3SCN-?Fe(SCN)3。
(3)小組同學(xué)認(rèn)為不能排除O2直接氧化Ag繼而生成AgCl,對(duì)此設(shè)計(jì)實(shí)驗(yàn):。結(jié)果發(fā)現(xiàn),該實(shí)驗(yàn)產(chǎn)生AgCl所需的時(shí)間更長(zhǎng)。說(shuō)明AgCl的產(chǎn)生主要與Fe3+有關(guān)。
(4)實(shí)驗(yàn)A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:。
(5)實(shí)驗(yàn)反思:鐵粉還原AgCl制取銀時(shí)應(yīng)控制鐵粉、鹽酸的濃度和浸泡時(shí)間等因素。組卷:96引用:2難度:0.5


