2021-2022學年湖北省武漢市武昌區水果湖高中高二(上)月考化學試卷(12月份)
發布:2024/9/12 10:0:8
一、單選題
-
1.下列關于電解質電離的敘述中正確的是( )
A.CaCO3在水中溶解度很小,其水溶液幾乎不導電,所以CaCO3是非電解質 B.AgCl在水中溶解度很小,但溶解的AgCl全部電離,所以AgCl是電解質 C.氯氣(Cl2)和氨氣(NH3)的水溶液導電性都很好,所以它們都是電解質 D.在電流作用下,鹽酸中的HCl電離成H+和Cl- 組卷:3引用:1難度:0.5 -
2.25℃時,水的電離達到平衡:H2O?H++OH-△H>0,下列敘述正確的是( )
A.向水中加入少量固體硫酸氫鈉,c(H+)增大,Kw不變 B.向水中加入氨水,平衡逆向移動,c(OH-)降低 C.向水中加入固體硫酸銅,平衡逆向移動,c(OH-)減小 D.將水加熱,Kw增大,pH減小,顯酸性 組卷:9引用:3難度:0.7 -
3.常溫條件下,0.1mol/LNaCN溶液與0.05mol/LHCl溶液等體積混合后,溶液微粒濃度排序正確的是( )(已知HCN的電離平衡常數Ka=6.2×10-10)
A.c(Na+)>c(Cl-)>c(HCN)>c(CN-)>c(OH-)>c(H+) B.c(Na+)>c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+) C.c(Na+)>c(CN-)>c(Cl-)>c(HCN)>c(H+)>c(OH-) D.c(Na+)>c(OH-)>c(HCN)>c(Cl-)>c(H+)>c(CN-) 組卷:79引用:4難度:0.6 -
4.廣義的水解觀認為:無論是鹽的水解還是非鹽的水解,其最終結果是反應中各物質和水分別離解成兩部分,然后兩兩重新組合成新的物質。根據上述觀點,說法不正確的是( )
A.BaO2的水解產物是Ba(OH)2和H2O2 B.PCl3的水解產物是HClO和H3PO3 C.Al4C3的水解產物是Al(OH)3和CH4 D.CH3COCl的水解產物是兩種酸 組卷:122引用:3難度:0.8 -
5.下列溶液中離子濃度關系表示正確的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) B.pH=3的CH3COOH與pH=11的NaOH溶液等體積混合后的溶液中:c(H+)<c(OH-) C.0.1mol/L的NH4Cl溶液中,c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.物質的量濃度相等的CH3COOH和CH3COONa溶液等體積混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) 組卷:238引用:16難度:0.5 -
6.如圖是以市售鐵屑(含少量錫、氧化鐵等雜質)為原料生產純凈綠礬的一種方法。已知:室溫飽和H2S溶液的pH約為3.9,SnS沉淀完全時溶液的pH為1.6,FeS開始沉淀時溶液的pH為3.0,沉淀完全時的pH為5.5。根據如圖所示流程圖,下列說法錯誤的是( )
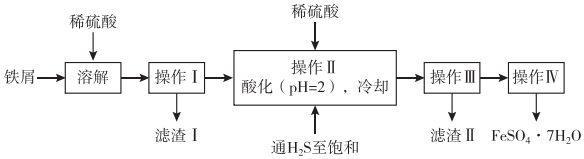
A.“溶解”中用到25%的稀硫酸,可用98%濃硫酸配制,需玻璃棒、燒杯、量筒、膠頭滴管等儀器 B.操作Ⅱ中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解 C.操作Ⅱ中,通入H2S至飽和的目的是使Sn2+轉化為SnS沉淀并防止Fe2+被氧化 D.操作Ⅳ中所得的晶體最后用乙醇洗去晶體表面附著的水分 組卷:22引用:4難度:0.7
二、解答題(共4小題,滿分0分)
-
18.氯化亞銅是一種白色粉末,難溶于水,溶于濃鹽酸生成氯亞銅酸,常用作催化劑、殺菌劑。以輝銅礦(主要成分為Cu2S,含少量Fe2O3、SiO2 等雜質)和軟錳礦(主要成分MnO2)為原料制備堿式碳酸銅,并進一步制取氯化亞銅 (CuCl)的工藝流程如圖:
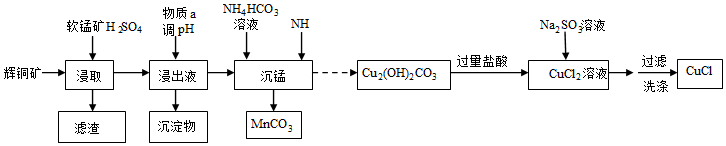
已知:①CS2的沸點為46.2℃
②常溫下幾種物質開始沉淀與完全沉淀時的pH如表
請回答下列問題:金屬離子 Fe2+ Fe3+ Cu2+ Mn2+ 開始沉淀 7.5 2.7 5.6 8.3 完全沉淀 9.0 3.7 6.7 9.8
(1)為加快“浸取”速率,除將輝銅礦粉碎外,還可采取的措施有(任寫一種),浸取過程中得到一種單質,寫出主要反應的化學方程式,該單質可用CS2提取回收,回收過程中溫度應控制在40℃~45℃之間,不宜過高的原因是。
(2)調節pH的范圍為,物質a可選用(填序號)。
A.CuO
B.Fe2O3
C.CuCO3
D.MnO2
(3)“沉錳”時發生反應的離子方程式。
(4)得到的CuCl晶體需用水洗,判斷晶體是否洗滌干凈的操作是。組卷:22引用:2難度:0.6 -
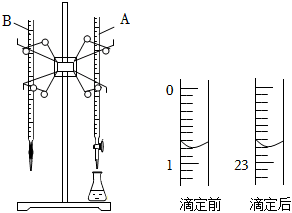 19.酸堿反應是生產生活實際中常見的反應之一。如圖是用0.1000mol/L的鹽酸滴定某未知濃度的NaOH溶液的示意圖和某次滴定前、后盛放鹽酸的滴定管中液面的位置。
19.酸堿反應是生產生活實際中常見的反應之一。如圖是用0.1000mol/L的鹽酸滴定某未知濃度的NaOH溶液的示意圖和某次滴定前、后盛放鹽酸的滴定管中液面的位置。
請回答下列問題;
(1)儀器A的名稱是。
(2)依上圖所示,此次滴定鹽酸消耗的體積為mL。
(3)某實驗小組同學的三次實驗的實驗數據如下表所示。①此次滴定時選擇的指示劑為,②則待測NaOH溶液的平均濃度是mol/L(保留四位有效數字)
(4)對下列實驗過程,因操作不正確而引起的誤差,使待測NaOH溶液濃度偏高的有實驗編號 待測NaOH溶液的體積/mL 滴定前鹽酸的體積讀數/mL 滴定后鹽酸的體積讀數/mL 1 20.00 1.20 23.22 2 20.00 1.21 29.21 3 20.00 1.50 23.48 (填序號)。
①酸式滴定管水洗后在裝液前未用標準鹽酸潤洗2~3次
②開始實驗時酸式滴定管尖嘴部分有氣泡,在滴定過程中氣泡消失
③錐形瓶未干燥,有少量蒸餾水
④盛NaOH溶液的錐形瓶滴定前用NaOH溶液潤洗2~3次
⑤放出堿液的滴定管開始有氣泡,放出液體后氣泡消失
⑥溶液顏色較淺時滴入酸液過快,停止滴定后反加一滴NaOH溶液,顏色無變化
⑦酸式滴定管滴定前仰視讀數,滴定后俯視讀數
⑧振蕩錐形瓶時部分液體濺出
(5)某實驗小組為測定某固體樣品中(NH4)2Fe(SO4)2?6H2O的含量,該物質的摩爾質量為392g.mol-1,做了如下實驗:
測定原理:MnO4-+Fe2++H+→Mn2++Fe3++H2O(方程式未配平)
測定步驟:步驟一,準確稱量20.00g樣品,配制成100mL溶液。步驟二,取所配溶液25.00mL于錐形瓶中,加稀H2SO4酸化,用0.1000mol?L?1 KMnO4溶液滴定至終點,重復兩次,平均消耗KMnO4溶液16.00mL。
①如何判斷到達滴定終點?。
②產品中(NH4)2Fe(SO4)2?6H2O的質量分數為%(保留到小數點后一位)組卷:102引用:2難度:0.5


