2021-2022學年福建省福州高級中學高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題僅有一個選項符合題目要求每小題4分,共32分)
-
1.下列設備工作時,可以實現化學能轉化為電能的是( )
A B C D 太陽能集熱器 鋰離子電池 電飯煲 風力發電機 



A.A B.B C.C D.D 組卷:7引用:3難度:0.8 -
2.下列有關說法正確的是( )
A.電解法精煉銅時,以粗銅作陰極,純銅作陽極 B.反應N2(g)+3H2(g)?2NH3(g)的ΔH可通過下式估算:ΔH=(反應中形成新共價鍵的鍵能之和)-(反應中斷裂舊共價鍵的鍵能之和) C.一定溫度下向恒容密閉容器中充入SO2和O2,當反應到達平衡時,容器中SO2、O2、SO3的物質的量之比為2:1:2 D.常溫下,向NH4Cl溶液中加入少量鹽酸,溶液中 的值增大c(H+)c(NH4+)組卷:4引用:1難度:0.6 -
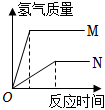 3.等質量的M、N兩種金屬,分別與相同質量分數的足量稀鹽酸反應(已知M、N在生成物中均為+2價),生成氫氣質量和反應時間的關系如圖所示,下列敘述正確的是( )
3.等質量的M、N兩種金屬,分別與相同質量分數的足量稀鹽酸反應(已知M、N在生成物中均為+2價),生成氫氣質量和反應時間的關系如圖所示,下列敘述正確的是( )A.M、N兩種金屬中較活潑的是N B.生成H2的質量M<N C.相對原子質量較大的是N D.產生H2的快慢程度為N>M 組卷:23引用:1難度:0.7 -
4.25℃時將1molA和1molB充入體積為1L的密閉容器中,發生反應:aA(g)+B(g)?C(g)+D(g) ΔH>0,5min后達到平衡。已知該溫度下反應的平衡常數K=1,若溫度不變,將容器的體積擴大為原來的2倍,A的轉化率不發生變化。下列選項錯誤的是( )
A.a=1 B.達平衡時B的轉化率為60% C.0~5min內v(A)=0.1mol?L-1?min-1 D.平衡后,若再加入1molB,重新平衡后,A的體積分數減小 組卷:36引用:5難度:0.5 -
5.下列各組物質中都是強電解質的是( )
A.HF、HCl、BaSO4 B.NH4F、CH3COONa、Na2S C.NaOH、Ca(OH)2、NH3?H2O D.HClO、NaF、Ba(OH)2 組卷:90引用:4難度:0.8 -
6.下列溶液不一定呈中性的是( )
A.pH=6的水 B.CsCl水溶液 C.c(H+)=10-7mol/L的溶液 D.通電一段時間后的Na2SO4溶液 組卷:23引用:4難度:0.6 -
7.在pH都等于4的醋酸和氯化銨兩種溶液中,設由水電離產生的H+濃度分別為amol?L-1和bmol?L-1,則a與b的關系正確的是( )
A.a<b B.a=b C.a>b D.無法確定 組卷:36引用:1難度:0.7 -
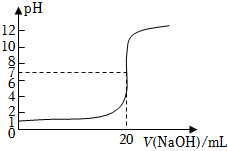 8.下列說法正確的是( )
8.下列說法正確的是( )A.用石墨電極電解熔融Al2O3時,陽極須定期更換 B.如圖所示為向10mL一定濃度的HCl溶液中滴加NaOH溶液時,所得室溫下溶液pH隨NaOH溶液體積的變化,由圖可知c(NaOH)=0.1mol?L-1 C.由方程式CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-890.3kJ?mol-1可知甲烷的燃燒熱為890.3kJ?mol-1 D.C(s)+H2O(g)?CO(g)+H2(g)在一定條件下能自發進行的原因是ΔH>0 組卷:5引用:1難度:0.5
二、非選擇題(本題共3小題,共52分)
-
23.滴定法可用于測定樣品純度。
Ⅰ.雙指示劑法測定燒堿樣品(含Na2CO3)純度
【實驗步驟】
a.迅速稱取燒堿樣品0.50g,溶解后配制成100mL溶液,備用。
b.將0.1000mol/LHCl標準溶液裝入酸式滴定管,調零,記錄起始讀數V0=0.00mL;
c.用堿式滴定管取20.00mL樣品溶液于錐形瓶中,滴加2滴酚酞;以HCl標準溶液滴定至第一終點(此時溶質為NaCl和NaHCO3),記錄酸式滴定管的讀數V1=21.70mL;
d.然后再向錐形瓶內滴加2滴甲基橙,繼續用HCl標準溶液滴定至第二終點,記錄酸式滴定管的讀數V2=23.70mL
(1)滴定至第一終點的過程中,發生反應的離子方程式為。
(2)判斷滴定至第二終點的現象是溶液由色變為橙色。
(3)樣品中NaOH的質量分數w(NaOH)=%。(計算結果保留小數點后1位)
(4)下列操作會導致測得的NaOH質量分數偏高的是(填字母序號)。
a.達到第一終點前,錐形瓶中有氣泡產生
b.記錄酸式滴定管讀數V1時,俯視標準液液面
c.第一終點后繼續滴定時,錐形瓶中有少許液體濺出
Ⅱ.測定三草酸合鐵酸鉀K3[Fe(C2O4)3]?3H2O中鐵的含量:
第一步,稱量mg樣品于錐形瓶中,溶解后加稀H2SO4酸化,用cmol?L-1KMnO4溶液滴定至終點。
第二步,向上述溶液中加入過量鋅粉將Fe3+轉化為Fe2+,過濾、洗滌,將濾液及洗滌液全部收集到錐形瓶中。加稀H2SO4酸化,用cmol?L-1KMnO4溶液滴定
至終點,消耗KMnO4溶液VmL。
(5)第一步中滴定終點的現象是。
(6)第一步的作用是。
(7)第二步中計算出該晶體中鐵的質量分數的表達式是。組卷:30引用:2難度:0.5 -
24.當今,世界多國相繼規劃了碳達峰、碳中和的時間節點。因此,研發二氧化碳利用技術,降低空氣中二氧化碳含量成為研究熱點。
(1)大氣中的二氧化碳主要來自于煤、石油及其他含碳化合物的燃燒。已知25℃時,相關物質的燃燒熱數據如表:
則25℃時H2(g)和C(石墨,s)生成C6H6(1)的熱化學方程式為物質 H2(g) C(石墨,s) C6H6(l) 燃燒熱△H/(kJ?mol-1) -286 -394 -3268 。
(2)一氧化碳與氫氣的反應歷程如圖,其中吸附在催化劑表面上的物種用*標注。
①該反應歷程中控速步驟的能壘為eV。
②寫出虛線框內發生的化學反應方程式。
(3)105℃時,將足量的某碳酸氫鹽(MHCO3)固體置于真空恒容容器中,存在如下平衡:2MHCO3(s)M2CO3(s)+H2O(g)+CO2(g)。上述反應達平衡時體系的總壓為46kPa。保持溫度不變,開始時在體系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡時體系中水蒸氣的分壓小于5kPa,CO2(g)的初始壓強應大于△kPa。
(4)我國科學家研究Li-CO2電池,取得了重大科研成果,回答下列問題:
Li-CO2電池中,Li為單質鋰片,則該電池中的CO2在(填“正”或“負”)極發生電化學反應。研究表明,該電池反應產物為碳酸鋰和單質碳,且CO2電還原后與鋰離子結合形成碳酸鋰按以下4個步驟進行,寫出步驟Ⅲ的離子方程式。
Ⅰ.2CO2+2e-═C2O42-
Ⅱ.C2O42-═CO2+CO22-
Ⅲ.
Ⅳ.CO32-+2Li+═Li2CO3組卷:23引用:3難度:0.6


