2020年天津市七校聯考高考化學二模試卷
發布:2024/12/21 7:0:2
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.現代社會的發展與進步離不開材料,下列有關材料的說法不正確的是( )
A.港珠澳大橋路面使用了瀝青和混凝土,瀝青可以通過石油分餾得到 B.用于新版人民幣票面文字等處的油墨中所含有的Fe3O4是一種磁性物質 C.500米口徑球面射電望遠鏡被譽為“中國天眼”,其“眼眶”是鋼鐵結成的圈梁,屬于新型純金屬材料 D.國慶閱兵儀式上的坦克和軍車都噴涂著新式聚氨酯迷彩偽裝涂料,能適應多種環境背景下的隱蔽需求,聚氨酯屬于有機高分子材料 組卷:27引用:5難度:0.8 -
2.下列有關化學用語表示正確的是( )
A.對硝基甲苯的結構簡式: 
B.離子結構示意圖  既可以表示35Cl-,也可以表示37Cl-
既可以表示35Cl-,也可以表示37Cl-C.NH5的結構與NH4Cl相似,NH5的結構式: 
D.CO2的比例模型:  組卷:100引用:6難度:0.8
組卷:100引用:6難度:0.8 -
3.X、Y、Z、W是原子序數依次增大的短周期主族元素,它們之間可形成組成不同的多種可溶性常見鹽,其中有兩種組成為ZXY3、ZWY4.下列說法中正確的是( )
A.簡單離子半徑:r(W)>r(Z)>r(Y)>r(X) B.最常見氫化物的穩定性:X>Y C.Z2Y2中含有共價鍵且在熔融狀態下能導電 D.第一電離能:Y>X 組卷:84引用:1難度:0.5 -
4.下列轉化,在給定條件下能實現的是( )
①NaCl(aq)Cl2(g)電解FeCl3(s)Fe△
②Fe2O3FeCl3(aq)HCl(aq)無水FeCl3△
③N2NH3H2高溫高壓,強化劑NH4Cl(aq)HCl(aq)
④SiO2SiCl4HCl(aq)SiH2高溫A.①③ B.④ C.①② D.②③ 組卷:107引用:2難度:0.7 -
5.某晶體中含有極性鍵,關于該晶體的說法錯誤的是( )
A.不可能有很高的熔沸點 B.不可能是單質 C.可能是有機物 D.可能是離子晶體 組卷:513引用:13難度:0.9
二、解答題(共4小題,滿分64分)
-
15.(Ⅰ)。NiCl2是化工合成中最重要的鎳源,在實驗室中模擬工業上以金屬錐廢料(含Fe、Al等雜質)為原料生產NiCl2的工藝流程如圖。
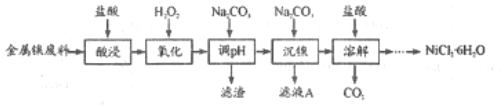
表列出了相關金屬離子生成氫氧化物沉淀的pH。
(1)為了提高鎳元素的浸出率,在“酸浸”時可采取的措施有氫氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Ni(OH)2 開始沉淀的pH 2.1 6.5 3.7 7.1 沉淀完全的pH 3.3 9.7 4.7 9.2 。(寫一條即可)
(2)加入H2O2時發生主要反應的離子方程式為。
(3)“調pH”時,控制溶液pH的范圍為≤pH<7。
(4)流程中由溶液得到NiCl2?6H2O的實驗操作步驟依次為、冷卻結晶、過濾、洗滌、干燥。
(Ⅱ)。高鐵酸鹽是優良的多功能水處理劑。K2FeO4為紫色固體,可溶于水,微溶于濃KOH溶液,難溶于有機物;在0~5℃、強堿性溶液中比較穩定,在酸性、中性溶液中易分解放出O2,某實驗小組制備高鐵酸鉀(K2FeO4)并測定產品純度,回答下列問題:
第一步:制備K2FeO4,裝置如圖所示,夾持,加熱等裝置略。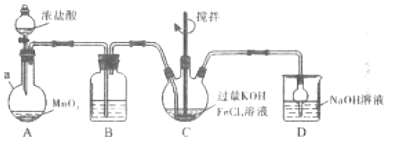
(5)儀器a的名稱是,裝置B中除雜質所用試劑是。
(6)C中反應為放熱反應,而反應溫度須控制在0~5℃,采用的控溫方法為,反應中KOH必須過量的原因是。
(7)寫出C中總反應的離子方程式。C中混合物經重結晶、有機物洗滌純化、真空干燥,得到高鐵酸鉀晶體。
第二步:K2FeO4產品純度的測定:準確稱取1.00g制得的晶體,配成250mL溶液,準確量取25.00mL K2FeO4溶液放入錐形瓶,加入足量CrCl3和NaOH溶液,振蕩,再加入稀硫酸酸化后得Fe3+和Cr2O72-,滴入幾滴二苯胺磺酸鈉作指示劑,用0.0500mol/L(NH4)2Fe(SO4)2標準溶液滴定至終點(溶液淺紫紅色),平行測定三次,平均消耗(NH4)2Fe(SO4)2標準溶液28.00mL。
(8)根據以上數據,樣品中K2FeO4的質量分數為。(K2FeO4摩爾質量為198g/mol)若(NH4)2Fe(SO4)2標準溶液部分變質,會使測定結果。(填“偏高”、“偏低”或“無影響”)。組卷:86引用:2難度:0.5 -
16.含氮的化合物廣泛存在于自然界,是一類非常重要的化合物,回答下列有關問題:

(1)在一定條件下:2N2(g)+6H2O(g)═4NH3(g)+3O2(g)。已知該反應的相關的化學鍵鍵能數據如表,則該反應的△H=kJ/mol。
(2)在恒容密閉容器中充入2mol NO2與1mol O2發生反應如下:4NO2(g)+O2(g)?2N2O5(g)化學鍵 N≡N H-O N-H O=O E/(kJ/mol) 946 463 391 496
①已知在不同溫度下測得N2O3的物質的量隨時間的變化如圖1所示,常溫下,該反應能逆向自發進行,原因是。
②下列有關該反應的說法正確的是。
A.擴大容器體積,平衡向逆反應方向移動,混合氣體顏色變深
B.恒溫恒容,再充入2mol NO2和1mol O2,再次達到平衡時NO2轉化率增大
C.恒溫恒容,當容器內的密度不再改變,則反應達到平衡狀態
D.若該反應的平衡常數增大,則一定是降低了溫度
(3)N2O5是一種新型綠色硝化劑,其制備可以用硼氫化鈉燃料電池作電源,采用電解法制備得到N2O5,工作原理如圖2,則硼氫化鈉燃料電池的負極反應式為。
(4)X、Y、Z.W分別是HNO3、NH4NO3、NaOH、NaNO2四種強電解質中的一種。上表是常溫下濃度均為0.01mol/L的X、Y、Z、W溶液的pH.將X、Y、Z各1mol同時溶于水中得到混合溶液,則混合溶液中各離子的濃度由大到小的順序為0.01mol/L的溶液 X Y Z W pH 12 2 8.5 4.5 。
(5)氮的氧化物與懸浮在大氣中的海鹽粒子相互作用時,涉及如下反應:
Ⅰ:2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
Ⅱ:2NO(g)+Cl2(g)?2ClNO(g)K2
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K=(用K1、K2表示)。
②在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO和0.1mol Cl2,10min時反應達到平衡,測得10min內v(ClNO)=7.5×10-3mol/(L?min),則平衡時NO的轉化率a1=;其他條件不變,反應Ⅱ在恒壓條件下進行,平衡時NO的轉化率a2a1(填“>”、“<”或“=”)。組卷:51引用:2難度:0.7


