2022年江蘇省鹽城市濱海中學高考化學模擬試卷
發布:2024/11/25 4:0:2
一、單項選擇題
-
1.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.28.4gP2O5( 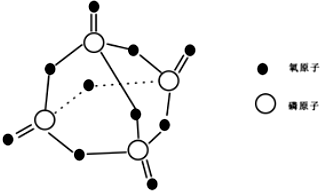 )含極性鍵的數目為0.4NA
)含極性鍵的數目為0.4NAB.已知核反應: U+23592n→10Ba+14456M+3ZAn,則1molZM中含中子數54NA10C.0.25molZn與一定量濃硫酸反應后完全溶解,生成氣體的分子數等于0.25NA D.1L1mol/LCH3COONa溶液中CH3COO-與OH-離子數之和小于NA 組卷:49引用:2難度:0.5 -
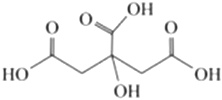 2.2021年12月9日,我國宇航員在中國空間站直播了泡騰片水球實驗。泡騰片中含有檸檬酸(結構如圖所示)和碳酸鈉等,溶于水產生氣泡。下列說法不正確的是( )
2.2021年12月9日,我國宇航員在中國空間站直播了泡騰片水球實驗。泡騰片中含有檸檬酸(結構如圖所示)和碳酸鈉等,溶于水產生氣泡。下列說法不正確的是( )A.易溶于水,相當于三元酸 B.1mol檸檬酸與足量鈉反應可得到2molH2 C.與檸檬酸官能團完全相同的同分異構體還有3種 D.一定條件下可發生酯化反應 組卷:26引用:3難度:0.6 -
3.依據下列實驗現象,得出的結論正確的是( )
操作 實驗現象 結論 A 蘸有濃氨水的玻璃棒靠近某溶液 有白煙產生 該溶液是濃鹽酸 B 將SO2通入BaCl2溶液 有白色沉淀生成 生成了BaSO3沉淀 C 加熱盛有少量NH4Cl固體的試管,并在試管口放置濕潤的藍色石蕊試紙 石蕊試紙變紅 NH4Cl顯酸性 D 取少量某無色溶液,先滴加氯水,再加入少量溴苯,振蕩、靜置 溶液分層,下層呈紫紅色 原無色溶液中一定有I- A.A B.B C.C D.D 組卷:33引用:3難度:0.5 -
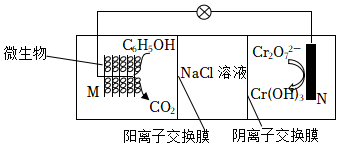 4.在K2Cr2O7存在下,利用微生物電化學技術實現含苯酚廢水的有效處理,同時向外界提供電能,其工作原理如圖所示。下列說法正確的是( )
4.在K2Cr2O7存在下,利用微生物電化學技術實現含苯酚廢水的有效處理,同時向外界提供電能,其工作原理如圖所示。下列說法正確的是( )A.N極為電池的正極,產生OH- B.工作一段時間后,NaCl溶液濃度增大 C.M極的電極反應為  +11H2O-23e-═6CO2↑+23H+
+11H2O-23e-═6CO2↑+23H+D.處理Cr2O72-時,OH-從陰離子交換膜左側向右側移動 組卷:99引用:3難度:0.5 -
5.LDFCB是電池的一種電解質,該電解質陰離子由同周期元素原子W、X、Y、Z構成,結構如圖,Y的最外層電子數等于X的核外電子總數,下列說法正確的是( )
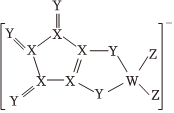
A.同周期元素第一電離能小于Y的有5種 B.簡單氫化物的還原性:X<Y C.W、Z形成的化合物分子是含有極性鍵的非極性分子 D.四種元素形成的簡單氫化物中X的最穩定 組卷:13引用:4難度:0.6 -
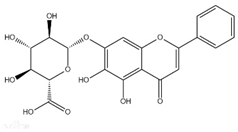 6.雙黃連口服液可抑制新冠病毒,其有效成分黃芩苷結構簡式如圖所示。下列說法正確的是( )
6.雙黃連口服液可抑制新冠病毒,其有效成分黃芩苷結構簡式如圖所示。下列說法正確的是( )A.黃芩苷的分子式是C21H16O11 B.黃芩苷不能使酸性高錳酸鉀溶液褪色 C.黃芩苷中苯環上的一氯代物只有4種 D.1mol黃芩苷最多與7mol氫氣發生加成反應 組卷:25引用:2難度:0.6 -
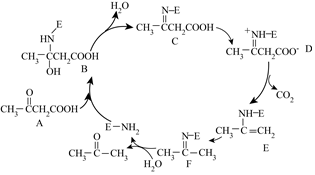 7.一種有機物脫羧反應機理如圖所示,下列說法不正確的是( )
7.一種有機物脫羧反應機理如圖所示,下列說法不正確的是( )A.E-NH2是脫羧反應的催化劑 B.該反應過程涉及加成、消去反應 C.E和F互為同分異構體 D. 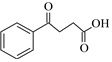 也可按照該反應機理生成
也可按照該反應機理生成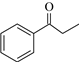 組卷:22引用:1難度:0.5
組卷:22引用:1難度:0.5 -
8.設NA為阿伏加德羅常數的值,下列說法不正確的是( )
A.由H218O與D216O組成的4.0g混合物含中子數為2NA B.100mL0.1mol?L-1 CH3COONa溶液中陰離子數目大于0.01NA C.標準狀況下,22.4L甲醇中含有-OH的數目為NA個 D.某密閉容器中0.1molNa2O2和0.1molSO2充分反應,轉移電子的數目為0.2NA 組卷:24引用:2難度:0.6 -
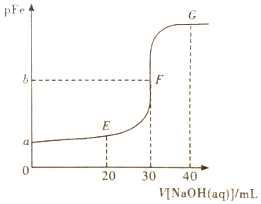 9.常溫下,向10mL0.1mol?L-1NH4Fe(SO4)2溶液中滴加pH=13的NaOH溶液,溶液中pFe[pFe=-lgc(Fe3+)]與NaOH溶液體積的關系如圖所示,已知Ksp[Fe(OH)3]≈2.7×10-39。下列說法正確的是( )
9.常溫下,向10mL0.1mol?L-1NH4Fe(SO4)2溶液中滴加pH=13的NaOH溶液,溶液中pFe[pFe=-lgc(Fe3+)]與NaOH溶液體積的關系如圖所示,已知Ksp[Fe(OH)3]≈2.7×10-39。下列說法正確的是( )A.NH4Fe(SO4)2溶液中:c(Fe3+)>c(NH4+)>c(H+)>c(OH-) B.在E、F、G三點中,水電離程度最大的是F C.溶液對應的某中性點位于圖像的F和G點之間 D.滴加NaOH溶液時,NH4+優先與NaOH反應 組卷:33引用:2難度:0.6 -
10.下列說法正確的是( )
A.1H+、2H、3H-互為同位素 B.CH3(CH2)3OH和(CH3)2C(OH)CH3互為同系物 C.H2O2和H2O互為同素異形體 D.C2H5NO2和H2NCH2COOH互為同分異構體 組卷:26引用:1難度:0.9
二、第II卷非選擇題(50分)
-
31.有效去除煙氣中的NOx是環境保護的重要課題.
(1)O3能將NO和NO2轉化成綠色硝化劑N2O5.已知下列熱化學方程式:
2N2O5(g)═4NO2(g)+O2(g)ΔH=+106.2kJ?mol-1
2NO(g)+O2(g)═2NO2(g)ΔH=-114kJ?mol-1
2O3(g)═3O2(g)ΔH=-284.2kJ?mol-1
則反應2NO(g)+2NO2(g)+2O3(g)═2N2O5(g)+O2(g)的ΔH=.
(2)一種通過BaO和Ba(NO3)2的相互轉化脫除NO2的原理如圖1所示.脫除NO2的總反應為.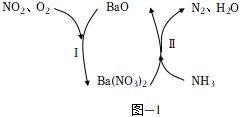
(3)NH3在催化劑作用下能與煙氣(主要為空氣,含少量NOx)中的NOx反應,實現NOx的脫除.常見的催化劑有V2O5等.反應的催化劑附在載體的表面,該載體為Ti的氧化物,其有兩種晶體類型,分別如圖2(a)、(b)所示,其中晶體a比表面積大,附著能力強,可用作載體,一定溫度下可轉化為晶體b.在V2O5催化下,NOx的脫除機理如圖3所示.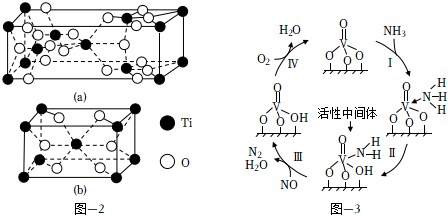
①晶體b的化學式為.
②轉化Ⅳ中,V元素化合價的變化為.
③脫除NOx時須控制反應的溫度,實驗發現,其他條件一定,當溫度過高時,NOx的脫除率會降低,原因除高溫下不利于NH3的吸附、催化劑本身活性降低外,還可能的原因是和.組卷:48引用:5難度:0.6 -
32.砷(As)位于元素周期表的第四行與氮、磷同列。砷有多種化合物,用途廣泛。完成下列填空:
(1)寫出砷原子核外最外層電子的電子排布式。
(2)1個砷的氫化物分子中含個化學鍵。
(3)砷化鎵(GaAs)和氮化鎵(GaN)都是原子間以共價鍵結合而成的晶體。GaAs熔點為1238℃、GaN熔點為1500℃,GaAs熔點低于GaN的原因是。
亞砷酸(H3AsO3) 可以用于治療白血病。25℃,向0.1mol?L-1H3AsO3溶液中滴加0.1mol?L-1 KOH溶液,各種微粒的物質的量分數與溶液pH的關系如圖所示。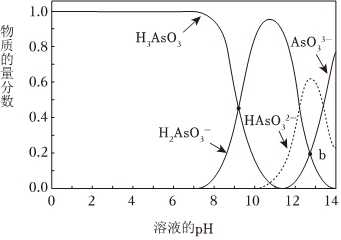
(4)人體血液的pH在7.35~7.45,患者用藥后人體中含砷元素的主要微粒是。
(5)25℃,H2電離程度小于水解程度,依據是:AsO-3。
(6)以酚酞為指示劑,將KOH溶液滴入H3AsO3溶液中,滴定終點的離子方程式是。
(7)b點溶液中:c(K+)2c()+4c(HAsO2-3) (選填“<”“>”或“=”)。AsO3-3組卷:28引用:2難度:0.6


