2021-2022學年福建省龍巖市六縣一中高三(上)期中化學試卷
發布:2024/11/30 12:0:2
一、選擇題:本題共10小題,每小題4分,共40分.在每小題給出的四個選項中,只有一項是符合題目要求的.
-
1.化學與人類社會、生產和生活密切相關.下列有關說法錯誤的是( )
A.高空臭氧層能吸收紫外線,保護地球上的生物 B.利用明礬中鋁離子的水解反應,可對疫區的污水進行消毒 C.采取靜電除塵、燃煤固硫、汽車尾氣催化凈化等方法,可提高空氣質量 D.PM2.5表示每立方米空氣中直徑小于或等于2.5微米的顆粒物的含量,PM2.5的值越高,大氣污染越嚴重 組卷:7引用:1難度:0.6 -
2.下列物質應用正確的是( )
A.用浸泡過高錳酸鉀溶液的硅藻土保鮮水果 B.碳酸鋇可用于胃腸X射線造影檢查 C.泡沫滅火器可用于金屬鈉著火時滅火 D.用淀粉溶液檢驗加碘(KIO3)食鹽中的碘元素 組卷:1引用:1難度:0.7 -
3.設NA為阿伏加德羅常數的值.下列說法正確的是( )
A.46g乙醇中含有的碳氫鍵數目為6NA B.1L0.1mol?L-1CH3COOH水溶液中含有的氧原子數為0.2NA C.向1LpH=1的氫碘酸中加入0.1mol K2Cr2O7,溶解后溶液中含有的Cr2O72-數為0.1NA D.向1L0.2mol?L-1酸性KMnO4溶液中滴加草酸(H2C2O4)溶液至溶液恰好變為無色時,轉移的電子數為NA 組卷:5引用:1難度:0.5 -
4.下列有關傳統文化的解讀正確的是( )
傳統文化摘錄 化學解讀 A 蠟燭有心還惜別,替人垂淚到天明 蠟燭和蛋白質的主要成分所含元素種類相同 B 以曾青涂鐵,鐵赤色如銅 氧化性:Cu2+>Fe2+ C 投泥撥水愈光明,爍玉流金見精悍 由煤轉化的水煤氣燃燒時放出的熱量與直接燃煤放出的熱量一樣多 D 紛紛燦爛如星隕,赫赫喧豗似火攻 焰色反應為化學變化 A.A B.B C.C D.D 組卷:18引用:4難度:0.7 -
5.下列離子方程式書寫正確的是( )
A.向CuSO4溶液中通入H2S氣體:Cu2++S2-═CuS↓ B.將FeO固體放入稀硝酸中:FeO+2H+═Fe2++H2O C.NaHSO4溶液與Ba(OH)2溶液反應至溶液呈中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O D.用氨水吸收煙氣中的二氧化硫:SO2+2OH-═SO32-+H2O 組卷:25引用:6難度:0.7
二、非選擇題:本題共5小題,共60分.
-
14.工業上從電鍍污泥(主要含有Fe2O3、CuO、Cr2O3及部分難溶雜質)中回收銅、鉻、鐵等金屬的流程如圖所示:
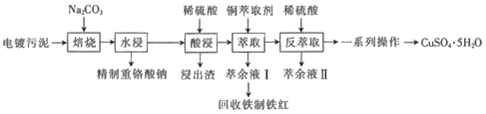
(1)經定性研究發現,電鍍污泥中含有少量的氯離子,氯離子對后續的處理增加了難度,需在“酸浸”前用純凈水洗滌氯離子,檢驗氯離子是否洗滌干凈的操作為。
(2)“焙燒”時,電鍍污泥中的鉻元素轉化為Na2CrO4的化學方程式為。
(3)下列關于“萃余液Ⅰ”“萃余液Ⅱ”的判斷正確的是(填標號);其中可循環利用的是。
A.“萃余液Ⅰ”“萃余液Ⅱ”都是水相
B.“萃余液Ⅰ”“萃余液Ⅱ”都是有機相
C.“萃余液Ⅰ”是水相,“萃余液Ⅱ”是有機相
D.“萃余液Ⅰ”是有機相,“萃余液Ⅱ”是水相
(4)“一系列操作”包括、洗滌。
(5)工業中“回收鐵制鐵紅”所用的試劑是氨水,寫出該過程中發生反應的化學方程式(是離子反應的用離子方程式表示):。
(6)在工業中經常用CuSO4來制備其他的銅鹽,如向硫酸銅溶液中按一定比例加入NaHSO3、NaCl和NaOH來制備氯化亞銅(Cu2Cl2,白色,不溶于水),該反應的離子方程式為。組卷:4引用:1難度:0.5 -
15.維生素C又名抗壞血酸,具有較強的還原性,分子式為C6H8O6,在醫藥和化學上有廣泛應用。某研究性學習小組設計用2,6-二氯酚靛酚標準溶液測定油白菜樣品中維生素C的含量。2,6-二氯酚靛酚鈉鹽(C12H6O2NCl2Na)呈藍色,酸化后生成的氧化型2,6-二氯酚靛酚(C12H7O2NCl2)呈粉紅色,被還原后變為無色的還原型2,6-二氯酚靛酚(C12H7O2NCl2)。
Ⅰ.配制2,6-二氯酚靛酚標準溶液
用2,6-二氯酚靛酚鈉鹽固體配制450mL0.010mol?L-1,2,6-二氯酚靛酚標準溶液的步驟如圖所示: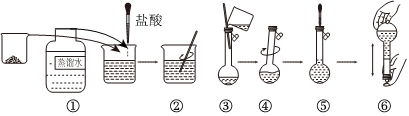
(1)在配制過程中必要的儀器有燒杯、玻璃棒、膠頭滴管、電子天平和;檢驗操作④所用儀器是否漏水的操作是。
(2)經計算,需2,6-二氯酚靛酚鈉鹽固體的質量為g。
(3)此實驗中玻璃棒的作用是。
(4)下列操作不會對所配得的2,6-二氯酚靛酚標準溶液的濃度產生影響的是(填標號)。
A.容量瓶用蒸餾水洗凈,沒有烘干
B.操作③沒有用蒸餾水洗滌燒杯2~30.010mol?L-1次,并轉移洗滌液
C.操作⑤仰視容量瓶的刻度線
D.操作⑥后,發現液面略低于刻度線,再滴加少量蒸餾水使液體凹液面的最低處與刻度線相平
Ⅱ.制備維生素C提取液
稱取20g洗凈的油白菜,向其中加入10mL酸化的蒸餾水(每10mL蒸餾水中加入10%鹽酸1滴),用榨汁機榨成糊狀,再用四層紗布過濾,反復抽提2~3次(紗布可用少量酸化的蒸餾水洗幾次),合并濾液(濾液渾濁可離心分離),定容至50mL備用。
Ⅲ.測定維生素C的含量
取25.00mL維生素C提取液于錐形瓶中,加入5mL10%鹽酸,再用的2,6-二氯酚靛酚標準溶液滴定,反應原理可表示為C6H8O6(抗壞血酸)+C12H7O2NCl2(氧化型2,6-二氯酚靛酚)→C6H6O6(脫氫抗壞血酸)+C12H9O2NCl2(還原型2,6-二氯酚錠酚)。滴定至終點時共消耗2,6-二氯酚靛酚標準溶液6.00mL。
(5)2,6-二氯酚靛酚標準溶液應該用(填“酸式”或“堿式”)滴定管盛裝。
(6)該油白菜樣品中維生素C的含量為mg?100g-1。組卷:3引用:2難度:0.5


