2019-2020學年安徽省合肥市高二(下)開學化學試卷
發布:2024/11/10 21:30:1
一、選擇題
-
1.能源是現代社會發展的重要支柱。下列屬于二次能源的是( )
A.太陽能 B.水力 C.潮汐能 D.電力 組卷:40引用:5難度:0.8 -
2.NA代表阿伏加德羅常數的值。下列說法中,不正確的是( )
A.28g N2含分子數目為NA B.1L 0.1mol/L KCl溶液中,含K+的數目為0.1NA C.標準狀況下,11.2L H2O含有的原子數目為1.5NA D.1mol Na2O和Na2O2的混合物中,所含陰離子數的總數為NA 組卷:18引用:3難度:0.8 -
3.下列離子方程式不正確的是( )
A.用硝酸銀溶液檢驗自來水中的氯離子:Ag++Cl-═AgCl↓ B.實驗室用碳酸鈣與稀鹽酸反應制備二氧化碳:CO32-+2H+═H2O+CO2↑ C.用稀硫酸清洗鐵銹(氧化鐵):Fe2O3+6H+═2Fe3++3H2O D.用銅與稀硝酸反應制備一氧化氮:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O 組卷:26引用:3難度:0.7 -
4.實驗是化學研究的基礎,關于下列各實驗裝置圖的敘述正確的是( )
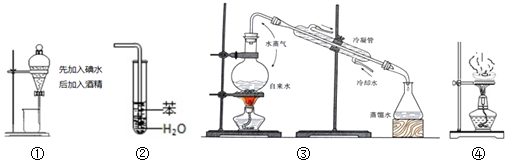
A.裝置①中液體上層無色,下層紫紅色 B.裝置②可用于吸收HCl氣體,并防止倒吸 C.裝置③可用于制取蒸餾水 D.裝置④中液體蒸干后停止加熱 組卷:7引用:3難度:0.5 -
5.下列有關銅片鍍銀的說法不正確的是( )
A.陽極反應式為Ag-e-═Ag+ B.銅片應與電源正極相連 C.電解液為AgNO3溶液 D.鍍銀過程中電能轉化為化學能 組卷:50引用:6難度:0.8 -
6.下列各組離子中,能在溶液里大量共存的是( )
A.H+、NH4+、SO42-、Cl- B.K+、Fe3+、OH-、SO42- C.Na+、H+、HCO3-、Cl- D.Ca2+、Na+、CO32-、NO3- 組卷:13引用:2難度:0.7 -
7.下列說法中,不正確的是( )
A. H和11H互為同位素21B.O2和O3互為同素異形體 C.CH4和C2H6互為同系物 D. 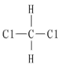 和
和 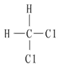 互為同分異構體組卷:26引用:2難度:0.9
互為同分異構體組卷:26引用:2難度:0.9
二、非選擇題
-
21.CuCl為白色粉末,微溶于水,不溶于乙醇,潮濕的CuCl在空氣中被氧化為Cu2(OH)3C1。
(1)一種由海綿銅(Cu)為原料制備CuCl的工藝流程如圖: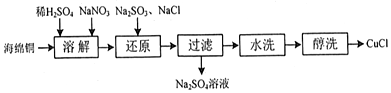
①“溶解”步驟發生反應的離子方程式為;
②潮濕的CuCl在空氣中被氧化的化學反應方程式為;
③已知常溫下Cu(OH)2溶度積常數Ksp=2×10-20,要使c(Cu2+)=0.2mol/L的硫酸銅溶液中的銅離子沉淀比較完全(使銅離子濃度變為原來的千分之一)則應調節溶液pH為以上。
(2)次磷酸(H3PO2)是一元中強酸,可用于作金屬表面處理劑。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,寫出反應的化學方程式:;
②H3PO2可將溶液中的Ag+還原為銀,從而用于化學鍍銀,反應同時生成P元素最高價氧化物對應的水化物。在該過程中,氧化劑與還原劑的物質的量之比為:。
③NaH2PO2的水溶液呈弱堿性,用離子方程式說明原因:。組卷:3引用:2難度:0.5 -
22.研究電解質在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的電離常數如表:
①寫出H2S的Ka1的表達式:化學式 HF H2CO3 H2S 電離平衡常數K(25℃) 7.2×10-4 Ka1═4.4×10-7
Ka2═4.7×10-11Ka1═9.1×10-8
Ka2═1.1×10-12;
②常溫下,pH相同的三種溶液NaF、Na2CO3、Na2S,物質的量濃度最小的是。
③將過量H2S通入Na2CO3溶液,反應的離子方程式是。
(2)室溫下,用0.100mol?L-1鹽酸溶液滴定20.00mL 0.100mol?L-1的氨水溶液,滴定曲線如圖1所示。(忽略溶液體積的變化,①②b填“>”“<”或“=”)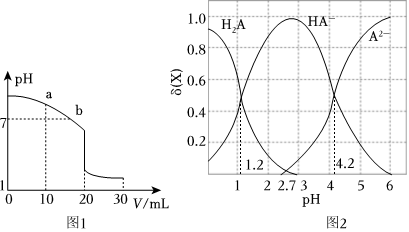
①a點所示的溶液中c(NH3?H2O)c(Cl-)。
②b點所示的溶液中c(Cl-)c()。NH+4
③室溫下pH=11的氨水與pH=5的NH4Cl溶液中,由水電離出的c(H+)之比為。
(3)二元弱酸H2A溶液中H2A、HA-、A2-的物質的量分數δ(X)隨pH的變化如圖2所示。則H2A第二級電離平衡常數Ka2=。組卷:35引用:4難度:0.6


