2023年天津市河東區高考化學一模試卷
發布:2024/4/20 14:35:0
一、本題包括12小題,每小題3分,共36分。每小題只有一個選項符合題意
-
1.化學與生活密切相關。下列敘述不正確的是( )
A.油脂是一種沒有固定熔沸點的有機高分子混合物 B.燃煤取暖,燃燒過程是將化學能轉化成熱能 C.冰的密度比水小,是因為水分子間存在氫鍵 D.我國古代的青銅器是由含銅合金制成的 組卷:63引用:1難度:0.6 -
2.如圖是人體含量較多元素的質量分數圖,下列有關這些元素的說法不正確的是( )

A.原子半徑:N<P B.第一電離能:K>Ca C.基態O原子的價層電子軌道表示式 
D.圖中的七種元素中有2種元素位于周期表第4周期 組卷:109引用:1難度:0.8 -
 3.一種吲哚生物堿中間體的結構簡式如圖所示,下列說法不正確的是( )
3.一種吲哚生物堿中間體的結構簡式如圖所示,下列說法不正確的是( )A.該物質屬于芳香族化合物 B.分子中含有酰胺基 C.該物質能發生取代反應、加成反應 D.分子中不含手性碳原子 組卷:99引用:1難度:0.6 -
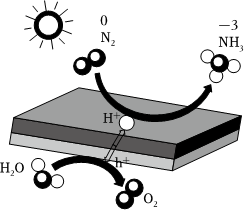 4.光催化固氮合成氨的機理如圖所示,下列說法不正確的是( )
4.光催化固氮合成氨的機理如圖所示,下列說法不正確的是( )A.NH3分子是極性分子 B.此反應中氮氣作氧化劑 C.無論使用哪種催化劑,同一個反應的活化能是不變的 D.此反應的化學反應方程式是:2N2+6H2O 4NH3+3O2催化劑光組卷:75引用:1難度:0.7 -
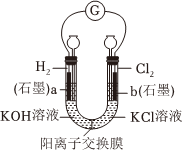 5.用如圖裝置進行實驗,產生電流。下列說法不正確的是( )
5.用如圖裝置進行實驗,產生電流。下列說法不正確的是( )A.b為電池的負極 B.工作一段時間后,a極附近溶液pH減小 C.K+從a極經陽離子交換膜移動到b極 D.該裝置的總反應為:H2+Cl2+2OH-═2Cl-+2H2O 組卷:155引用:1難度:0.5
二、第II卷(非選擇題,共64分)
-
15.實驗室利用紅磷(P)與Cl2反應可制取少量PCl3或PCl5。
Ⅰ.利用如圖所示裝置制取少量PCl3(部分夾持裝置已略去)。物質 熔點/℃ 沸點/℃ 性質 PCl3 -112 75.5 遇水生成H3PO3和HCl,與O2反應生成POCl3 PCl5 - 約100℃升華 遇水生成H3PO4和HCl,與紅磷反應生成PCl3 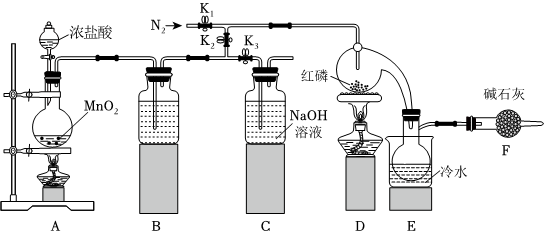
(1)組裝好裝置,在放入試劑前應先。
(2)A中發生反應的離子方程式為。
(3)B中所裝試劑為。
A.飽和碳酸氫鈉溶液
B.飽和氯化鈉溶液
C.氫氧化鈉溶液
D.濃硫酸
(4)實驗開始前,打開K1通入一段時間氮氣來除去裝置中的空氣,除去空氣的目的是;除去裝置A、B中空氣的具體方法是。
(5)除去產物中PCl5雜質的化學反應方程式是。
Ⅱ.測定產品中PCl3的質量分數
實驗步驟:
①迅速稱取mg產品,加水反應后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反應。
③向②所得溶液中加入幾滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振蕩,當溶液恰好由藍色變為無色時,記錄所消耗Na2S2O3溶液的體積。
④重復②、③操作3次,平均消耗Na2S2O3溶液V2mL。
(6)第①步溶于水的化學反應方程式是。
(7)逐滴滴加Na2S2O3溶液使用的儀器是(已知:H2S2O3是弱酸)。
(8)根據上述數據測得該產品中PCl3的質量分數為。(已知H3PO3+I2+H2O═H3PO4+2HI;I2+2Na2S2O3═2NaI+Na2S4O6)組卷:59引用:1難度:0.3 -
16.偏二甲肼與N2O4是常用的火箭推進劑,二者發生如下化學反應:(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)。
(1)反應(Ⅰ)中氧化劑是。
(2)火箭殘骸中常現紅棕色氣體,原因為:N2O4(g)?2NO2(g)(Ⅱ)。當溫度升高時,氣體顏色變深,則反應(Ⅱ)為(填“吸熱”或“放熱”)反應。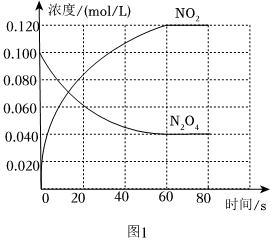
(3)100℃時,將1molN2O4充入一恒壓密閉容器中,體系中各物質濃度隨時間變化如圖1所示。在0~60s時段,反應速率v(N2O4)為mol?L-1?s-1;反應的平衡常數K1的數值為。
(4)溫度為T時反應達平衡后,將反應容器的容積減少一半,平衡向(填“正反應”或“逆反應”)方向移動,判斷理由是。
(5)利用反應6NO2+8NH3═7N2+12H2O構成電池,既減輕環境污染又充分利用了化學能。裝置如圖2所示,電池的負極反應是;離子交換膜是交換膜(填“陽離子”或“陰離子”)。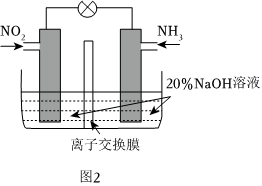 組卷:86引用:1難度:0.5
組卷:86引用:1難度:0.5


